2023年12月発行
《注目記事》
【特集】第166回老年学・老年医学公開講座 誌上開催
・老化は克服できるのか?~細胞老化の視点から~/老化制御研究チーム 研究副部長 杉本昌隆
・エクソソーム:大きな可能性を秘めた小さなメッセンジャー/老化機構研究チーム 研究員 川上恭司郎
・老いは脚から、だったら今から脚を鍛えて健康寿命を延伸してみましょう/順天堂大学大学院スポーツ健康科学研究科 教授 町田修一
《その他(PDFでお読みいただけます)》
・令和5年の総括及び新年に向けたご挨拶
・オーストラリア滞在記
・表彰一覧
・第167回老年学・老年医学公開講座レポート
・令和5年度厚労科研費、AMED科研費一覧
・主なマスコミ報道/編集後記
老化制御研究チーム 研究副部長 杉本昌隆
生物の最大寿命は種によって大きく異なり、ホッキョククジラやニシオンデンザメのように数百年生きるものもあれば、マウスのように3年程度で死んでしまうものもあります。このように最大寿命が種に固有のものであるということからは、寿命が予め遺伝的プログラムで決められているということが考えられます。では、この遺伝的プログラムを操作することによって、最大寿命を延ばすことはできるのでしょうか?線虫やショウジョウバエなどでは、特定の遺伝子を操作することにより最大寿命を大きく延ばすことが可能です。一方で、マウスなどの哺乳動物では現時点で最大寿命を大幅に延ばすには至っていません。高等生物では寿命の制御がより複雑になり、老化が極めて複雑な複合的生命現象と化していることに原因があると思われます。
近年、老化のメカニズムのひとつとして、細胞の老化が注目を集めています。ヒトの体は数十兆個の細胞によって構成されており、それぞれの組織においてこれら細胞は特異的な機能を発揮します。しかしながら年を取ると、若い時には見られない性質の変化した細胞が見られるようになります。
私たちヒトを含む哺乳動物の細胞は、DNA損傷などのストレスを受けると、"細胞老化"と呼ばれる増殖停止状態に陥ります。細胞老化はがん化してしまうリスクの高い危険な細胞の増殖を防ぐ極めて重要な防御機構として機能しています(図1)。ダメージを受けて細胞老化を起こした細胞(老化細胞)は生体内で免疫系の働きにより排除されますが、加齢とともにこの排除系が低下して組織内に老化細胞が蓄積するようになります。その結果、老齢個体では組織内に老化細胞が蓄積するようになります。
さらに老化細胞は増殖機能を喪失するだけでなく、炎症や組織リモデリング(慢性的な炎症により、組織を構成する細胞の種類・機能・相互作用の変化が生じ、組織機能が影響を受ける状態)などを
誘発する様々な生理活性物質を分泌するようになり、周辺の老化していない細胞にも影響を与えるようになります(図2)。このような老化細胞特異的な分泌表現型はSASPと呼ばれ、それによる作用が、組織機能の変化(低下)や慢性疾患病態に関与すると考えられています。
図1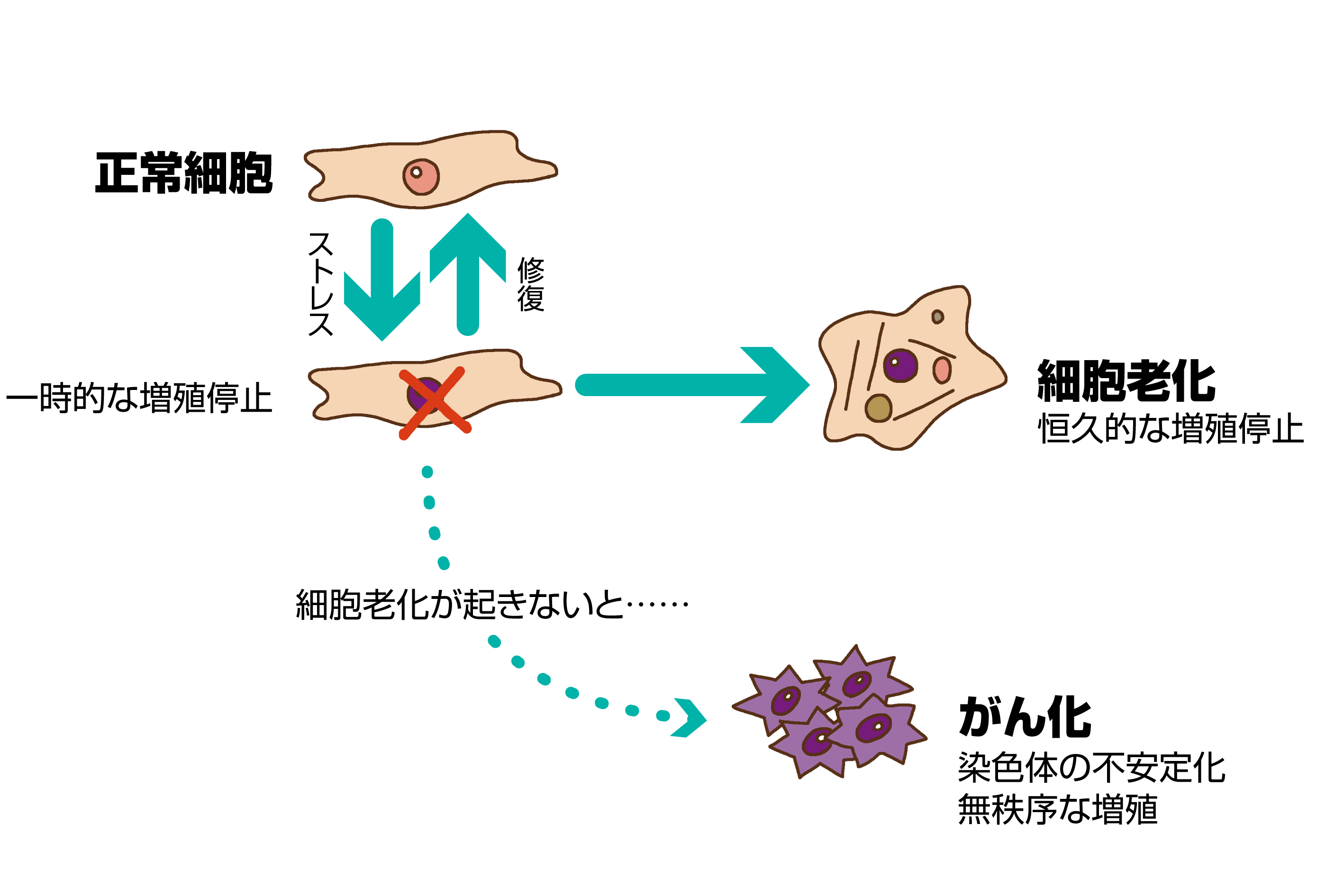
図2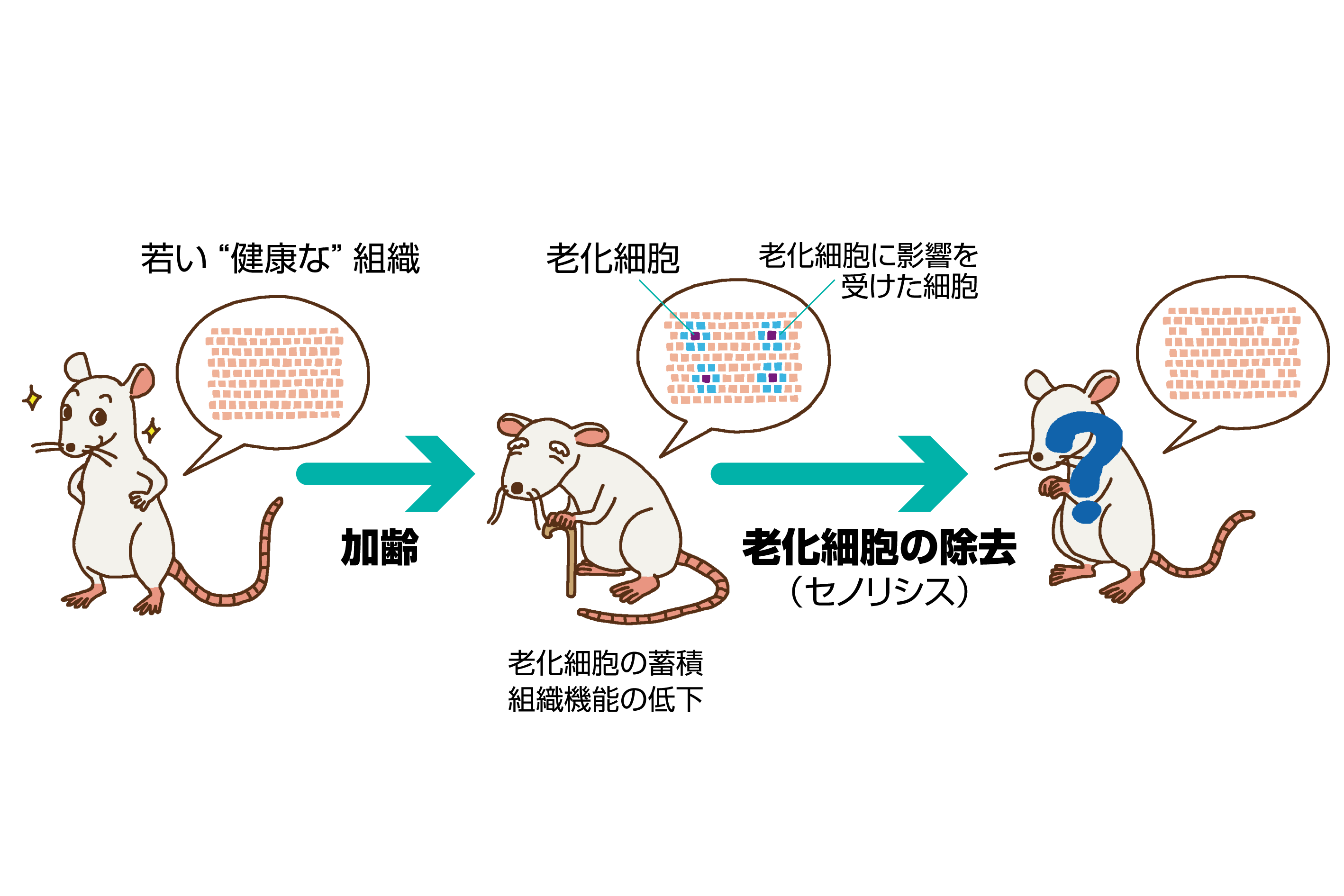
老化細胞と組織の老化や病態との関連について研究するために、過去10年ほどで私たちを含む多くの研究グループが、生体から老化細胞を排除可能なモデル動物(遺伝子改変動物など)を作製し、研究を行ってきました(図2)。これらの研究からは、様々な組織において、老化細胞の除去(セノリシス)が有益な効果を示すことが明らかになりました。さらに動脈硬化、肺線維症、認知症などの疾患モデルを用いた研究からも、セノリシスが治療や病態の軽減などの効果を示し、また最近の研究ではCOVID-19病態も軽減されることが示されるなど、老化細胞が様々な疾患の創薬・治療標的となることが期待されています。
老化細胞は、正常細胞と比較して特定のシグナル経路に生存を強く依存するようになるため、シグナルの阻害剤に高い感受性を示すようになります。この性質を利用した老化細胞特異的に細胞死を誘導する薬剤(セノリティック薬)が、海外では既に特定の疾患を対象に臨床試験が行われています(表1)。
表1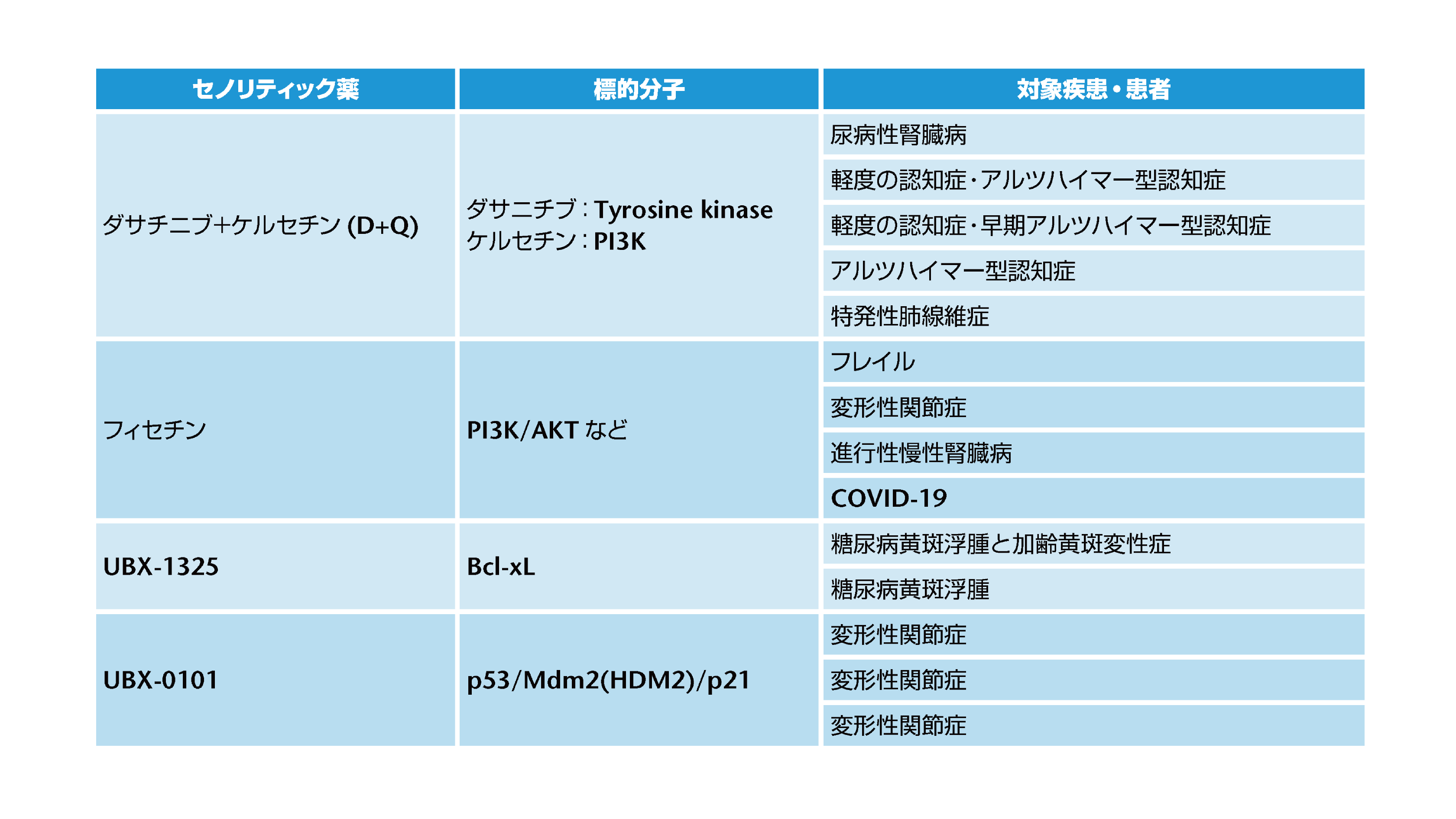
肺組織弾性の低下は、加齢とともに生じるエラスチンを主成分とする弾性線維量の減少に起因し、その結果として呼気流量(空気を吐く力)の低下に繋がります。ヒトの場合、20-30才をピークに1秒量(最大吸気から努力呼出したときの最初の1秒間で吐き出す空気量)は低下します。動物(マウス)においても同様に、呼吸機能の低下は性成熟後観察されるようになります。しかしながら老齢マウスにおいて肺組織の老化細胞を除去する処理を1 ヶ月間行うと、弾性線維の回復とともに呼吸機能の回復も認められました。これらの結果は、老化してしまった肺組織でも、老化細胞を除去することにより、部分的に"若返らせる"ことが可能であるということを示唆していると考えています(図3)。
図3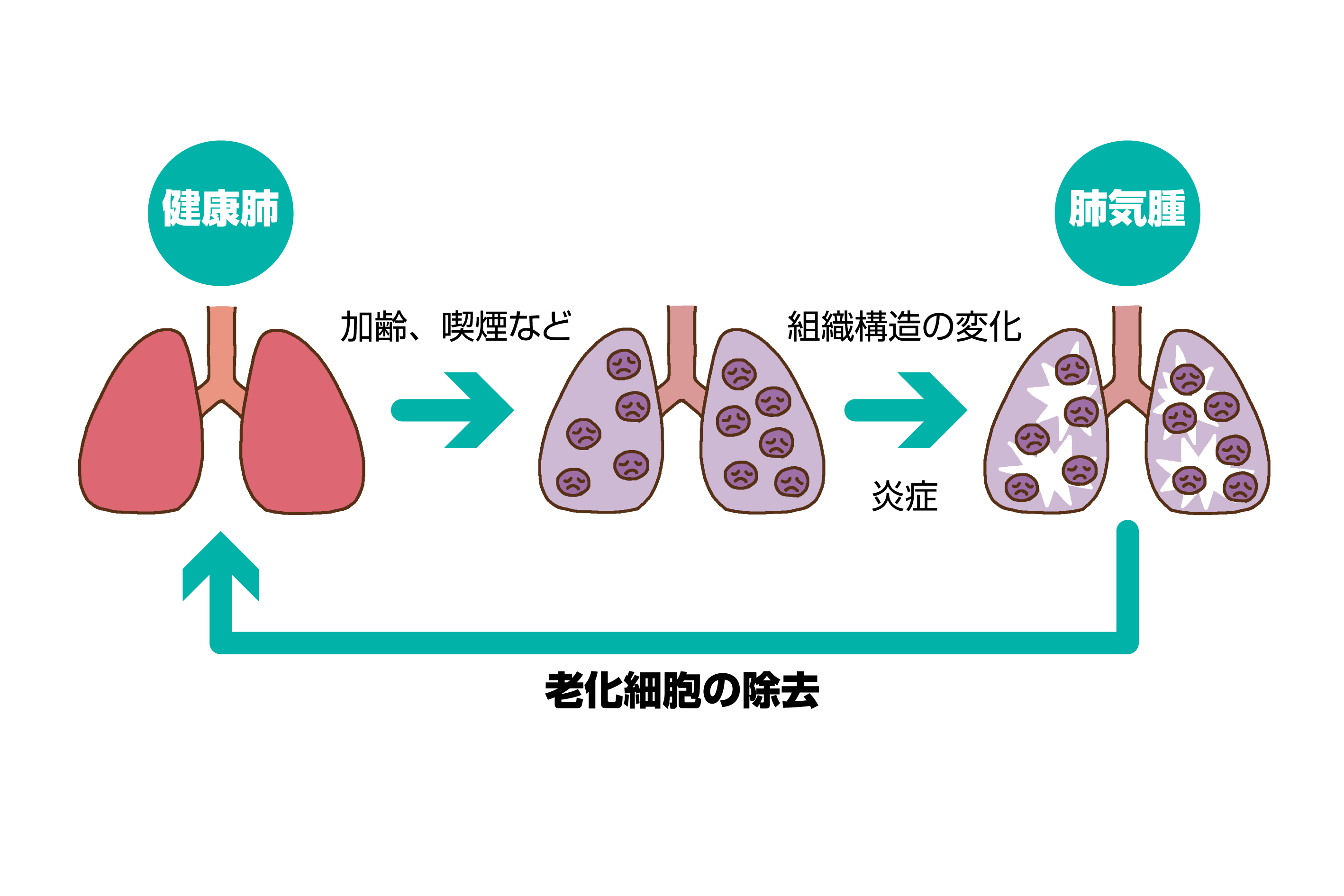
慢性閉塞性肺疾患(COPD)は、世界で常に死因の上位を占める疾患で、2016年の世界保健機構の調査では、死因の第3位となっています。近年、肺気腫モデル動物を用いた研究から、セノリシスを行った動物では肺気腫病態が顕著に抑制されることが明らかになりました。したがって老化細胞を標的とするアプローチは、肺気腫に対する有効な治療法確立へと繋がることが期待されます。
近年、老化研究は急速な発展を遂げており、なかでも細胞老化は臓器の老化や加齢性疾患など、私たちが直面する問題に深く関与することが明らかになっています。老化細胞の制御など、研究から得られた知見が社会に還元されるにはまだ時間を要しますが、健康長寿社会の実現のために、引き続き皆様のご理解とご支援を賜りますようお願い申し上げます。
▼杉本講師の講演を動画でご視聴いただけます。
老化機構研究チーム 研究員 川上恭司郎
エクソソームとは細胞から分泌される脂質二重膜から成る膜小胞で50-150nm(※1)くらいの大きさで、細胞が物質を取り込む機構の1つであるエンドサイトーシス経路から作られる膜小胞です。図1に示すように、クラスリン被覆小胞から始まるエンドサイトーシス(細胞が外から物質を取り込むこと)により形成された前期エンドソームがさらに陥入すると、腔内に多数の小胞を含む多胞体ができます。これが細胞膜と融合すると、細胞の外へ物質を放出する機構の1つであるエキソサイトーシスにより腔内の小胞が細胞外に分泌されます。こうしてできた小胞がエクソソームと呼ばれるもので、分泌されたエクソソームは、細胞と細胞の間や血液・尿・脳脊髄液などの体液中に存在します。
図1 エクソソームのできかた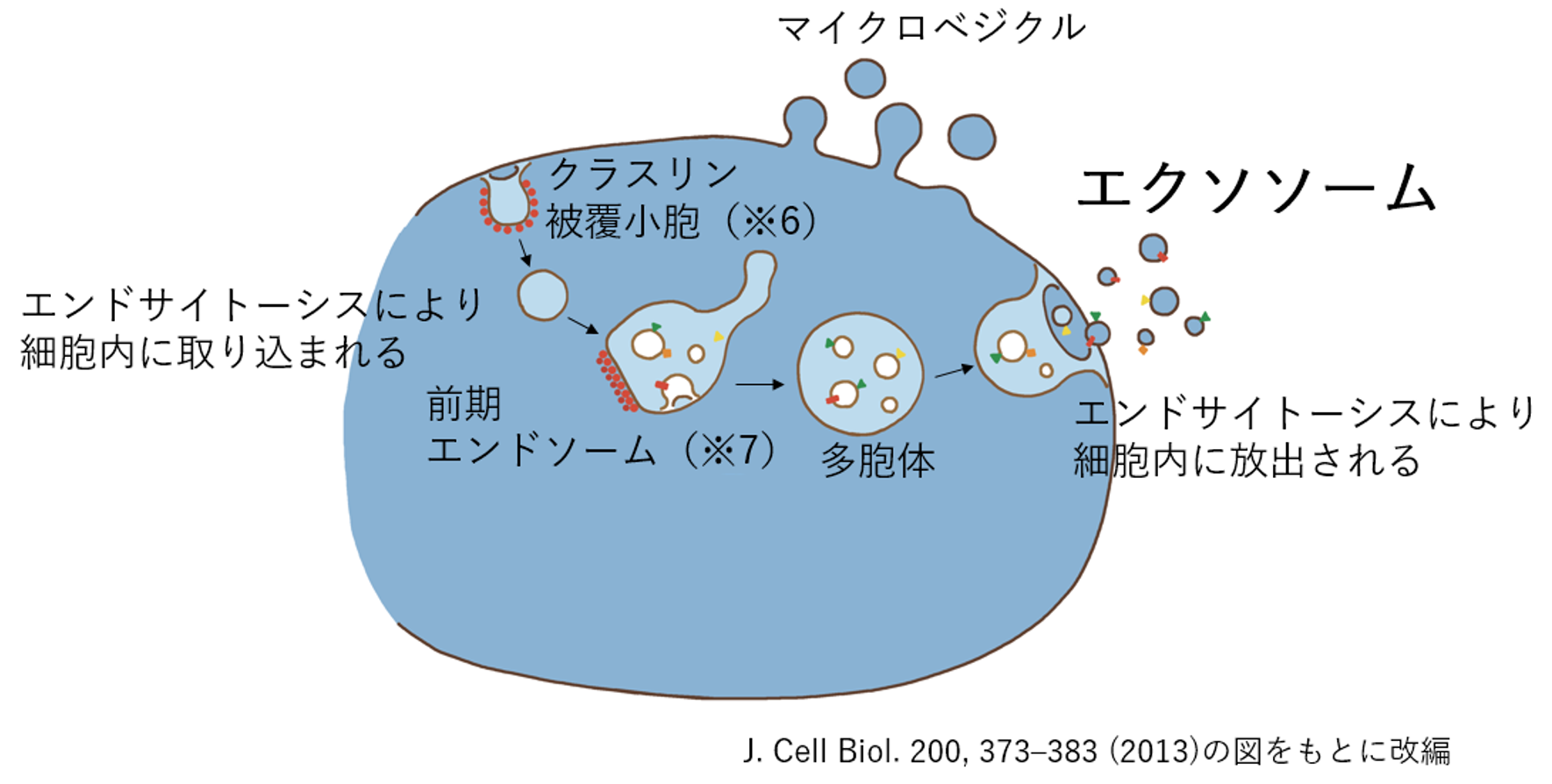
由来する細胞の小さなレプリカのようなエクソソームは放出された後、自身を含む近くの細胞に働くのはもとより、遠く離れた細胞にも血流に乗って辿り着くことが実験的に示されています(図2)。そして、エクソソームの表面にあるタンパク質が、標的とする細胞の表面に発現している受容体(受け手のタンパク質、作用すると細胞内にその刺激を伝える)に作用したり、エクソソームが標的とする細胞内に取り込まれたりしたのち、エクソソーム内部の核酸やタンパク質が、標的細胞の内部でその機能を発揮するという報告もあります(1)。
図2 エクソソームは自身や近傍の細胞のみならず、離れた細胞にも作用する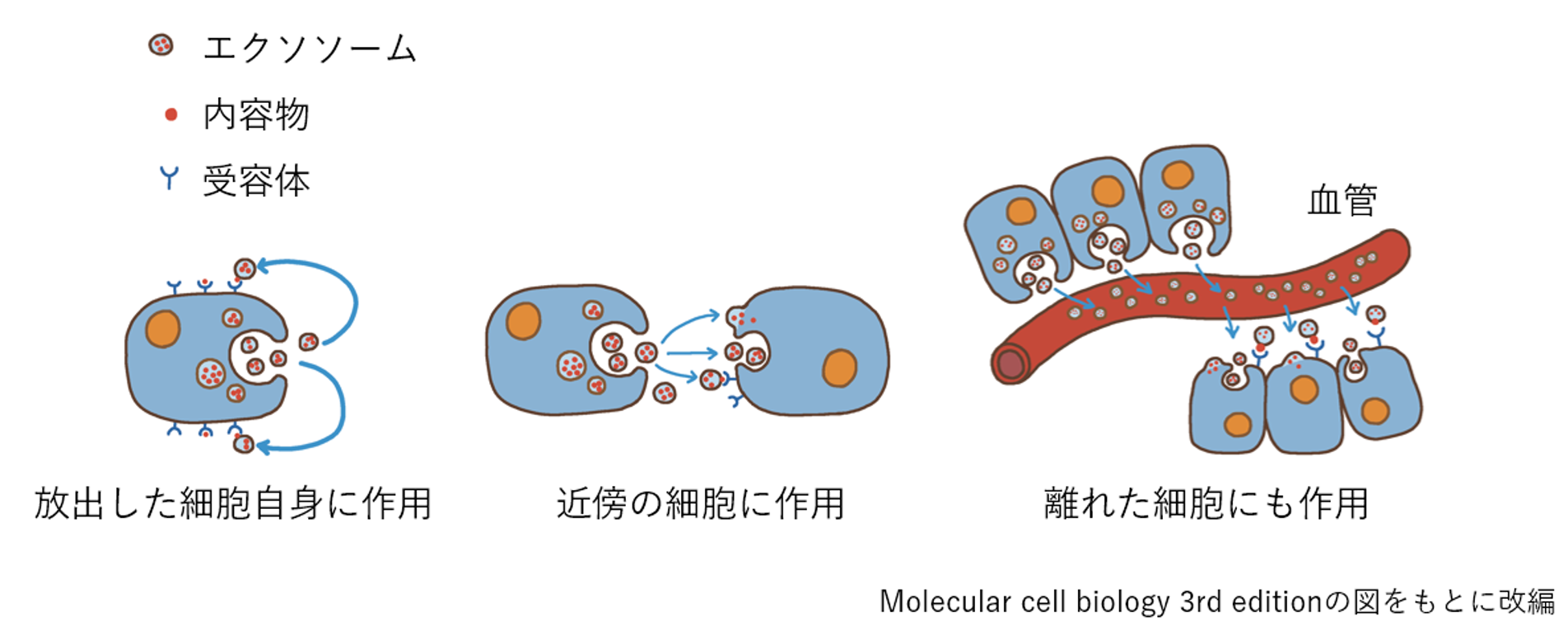
エクソソームは様々な疾患に関与することが知られています。以下、一例です。
①悪性腫瘍(がん)
がん細胞のエクソソームに含まれるメッセンジャーRNA(※2)が別の細胞に移ってタンパク質に翻訳されるという報告です(2)。悪性腫瘍から放出されるエクソソームが何をしているのかというと、がん細胞の生存に有利な環境を作るために一役買っています。有利な環境とは、がん細胞をみつけて排除しようとしてくる免疫細胞の機能を抑制したり、がん細胞の生存に欠かせない酸素を運んでくる血管の構築を促進したり、さらには、がん細胞が転移するときに、別の組織に転移しやすいように足場を作るということも実験的に示されています(3)。
②神経変性疾患
老化に関連する病気として重要である認知症などの神経変性疾患にもエクソソームが関与することが報告されています。脳を構成する細胞には電気信号を伝達する神経細胞のほか、グリア細胞と呼ばれる神経細胞の機能をサポートする細胞が存在しています。脳内ではそれぞれの細胞が綿密に連携して、脳の機能を維持しており、そこにもエクソソームが関わっています。しかしながら、エクソソームは通常の脳機能の維持だけでなく、病態にも関わることが最近わかってきました。アルツハイマー型認知症の原因の一つであるタンパク質(アミロイドβやタウタンパク質)がエクソソームを介して細胞間で広がることが示唆されています(4)。
前述のようにエクソソームは疾患と綿密な関係にあることから、体液中のエクソソームを病気の診断や治療に用いようという研究が進められてい
ます。
①病気の診断
例えば、がん細胞から放出されるエクソソームに含まれるタンパク質やマイクロRNA(※3)を血中や尿中で検出することにより、がんの存在や悪性度を診断できる可能性が示されています。私たちの研究室でも、前立腺に特異的に発現しているPSMA(前立腺特異的膜抗原)と呼ばれるタンパク質を血中のエクソソーム上で検出するシステムを開発し、前立腺がんの転移を鑑別できる可能性を示しました(5)。
②病気の治療
一方、エクソソームを治療に用いようという研究も活発に行われています。間葉系幹細胞(※4)が分泌するエクソソームは、細胞分裂や血管新生(※5)の促進などを介して組織の修復を助けることが明らかになってきており、心筋梗塞部位の修復に用いるなどの試みなどがなされています。また、エクソソームは膜小胞でできているため、その内部にある物質を安定的に存在させることができます。
エクソソームに関連する研究は、病気の診断や治療など、医療応用への期待が高まっていますが、いずれも研究段階であり、実用化にはまだまだ時間がかかると思われますが、医療応用に向けた検討がなされており、今後の発展が期待される分野です。
【用語補足】
※1 nmはナノメートルと読み、1メートルの10億分の1の大きさを表す単位です。エクソソームの大きさ(50-150nm)はウイルスと同じくらいの大きさになります。
※2 メッセンジャーRNAはタンパク質を作る元となる遺伝情報(設計図)です。細胞核内でDNAから転写されて作られます。その後、細胞質で翻訳されタンパク質が作られます。
※3 マイクロRNAは細胞内に複数種類存在するRNAのうちの1つで、短い長さのRNAです。メッセンジャーRNAとは異なりタンパク質の設計図にはならずに、メッセンジャーRNAと相互作用することでタンパク質合成の制御を行っています。
※4 間葉系幹細胞は脂肪組織や骨髄などの中に存在している幹細胞で、骨芽細胞、脂肪細胞、筋細胞などに分化ができる細胞です。組織の損傷時にこの細胞が働いて組織修復が進むとされています。
※5 血管新生とは血管が新たに作られることです。血管がもともとの血管から枝分かれして新しい血管が伸びていくことで、損傷した組織にも血管が再生します。
※6 クラスリンタンパク質が細胞膜に集まり、膜が陥入することで作られた、クラスリンに覆われた小胞です。
※7 細胞内小胞の1つで、クラスリン被覆小胞と融合します。その後は細胞膜側に戻るか、分解される経路に分かれ処理が進みます。
【参考文献など】
1. Zomer A, et al, Cell, 2015, 161:1046-1057.
2. Valadi H, et al, Nat Cell Biol, 2007, 9:654-659.
3. Hoshino A, et al, Nature, 2015, 527:329-335.
4. Asai H, et al, Nat Neurosci, 2015, 18:1584-1593.
5. Kawakami K,et al, Sci Rep, 2021, 11:15000.
▼川上講師の講演を動画でご視聴いただけます。
順天堂大学大学院スポーツ健康科学研究科 教授 町田修一
運動器の一つである骨格筋は、加齢に伴い筋量や筋力が低下します。この加齢性の筋肉減弱症(サルコペニア)は、ADL(日常生活動作)やQOL(生活の質)が低下する原因の一つと考えられます。ロコモティブシンドローム(ロコモ)は、「骨・筋肉・関節などの運動器の障害のために移動機能の低下をきたした状態」と定義され、サルコペニアはロコモの中で運動器障害の中の一つと位置付けられます。サルコペニアやロコモが進行すると、運動器の疾患や機能低下が原因となって歩行機能やバランス機能などが低下します。超高齢社会を迎えた本邦において、ゆとりと豊かさに満ちた社会を実現するためには、ひとりひとりが高齢になっても自由で自立した生活を営めることが鍵となります。
骨格筋は筋線維の集合体です。筋線維は、その収縮特性から遅筋線維(赤筋)と速筋線維(白筋)に分類され、疲労耐性や筋力(張力)に違いが認められます(図1, 町田 2004)高齢期骨格筋においては、速筋線維に選択的な萎縮が認められるのが特徴です(Lexell et al., 1988)。ウォーキングのような運動強度の低い運動では、全ての筋線維が使われることはなく、疲労しにくい遅筋線維が優先的に利用されます。そして、速歩やジョギングのようにスピード(運動強度)が上がると、利用される筋線維の数も増えるとともに、速筋線維も利用されるようになります(町田, 2011)。既述のように、サルコペニアでは遅筋線維よりも速筋
線維の萎縮が優位であると考えられるため、主に遅筋線維を利用するウォーキングのような低強度の有酸素性運動のみでは、加齢に伴う速筋線維の萎縮の抑制効果として十分ではない可能性があります(町田, 2014)。すなわち、サルコペニアやロコモ、フレイルの予防・改善の観点からは、速歩等を取り入れることで速筋線維を利用するように工夫した有酸素性運動を含めた運動プログラムが推奨されます。
図1 骨格筋の構造と筋線維タイプ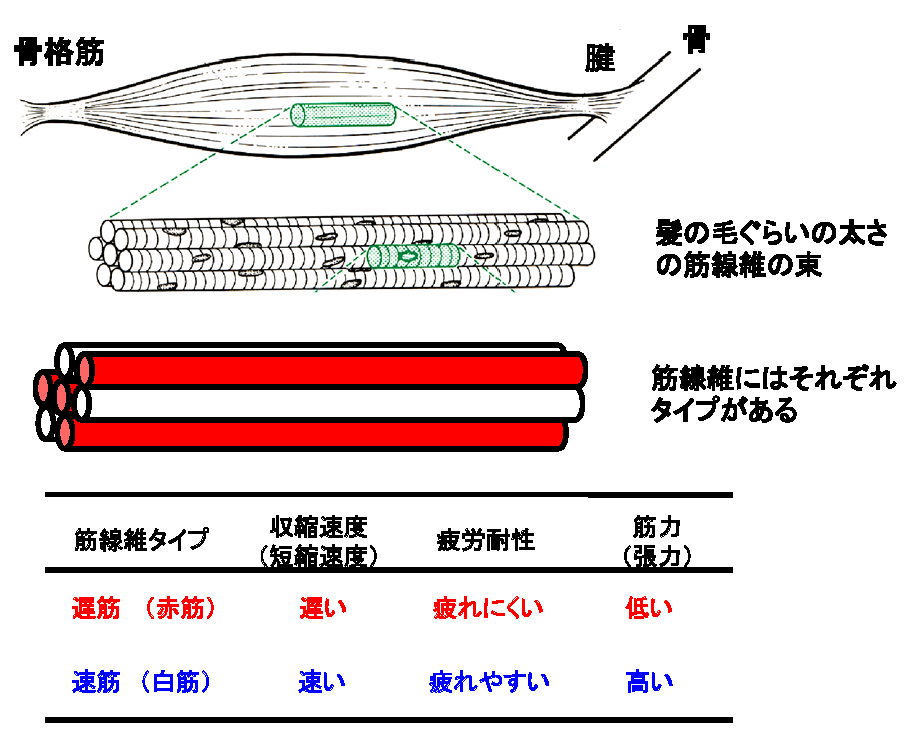
一般的には、筋肥大や筋力増強を目的とした場合、フィットネスクラブ等の運動施設にあるバーベルや特別なトレーニング機器を利用して負荷を高めることがよく行われますが、対象が高齢者である場合には、何らかの疾患を有している可能性や、高負荷による筋損傷とその後の再生能の低下を考慮する必要もあり、高い強度での運動の実施が難しい場合も多いです。そういった安全性への配慮から、高齢者の健康づくりや介護予防運動の現場では、低強度(最大筋力の60%以下)や自体重での筋力トレーニングが有効な手段として実施されています。
我々は最近、自体重を利用した軽負荷での筋力トレーニングによって高齢者の筋量、筋力、身体機能等を改善する「ロコモ予防運動プログラム」を開発しました(表1, Ozaki et al., 2020)。自体重を利用した筋力トレーニングは、いつでも、どこでも、誰とでも、手軽にできるという特長があります。我々の開発した運動プログラムでは、①回数、②動作スピード、③セット数、④セット間休息時間を段階的に変更することで運動強度を調整し、運動習慣のない高齢者でも無理なく取り組めるように考慮しています。具体的には、導入時に実施するのはスクワット、プッシュアップ、クランチ、ヒップリフトの4種目であり(図2)、これらを各種目8回×3セット(動作スピード:収縮3秒-伸張3秒、セット間休息:60秒)、週1~2回の頻度で実施することから始めます。そしてその後、2週間ごとにトレーニングの種目数や負荷強度を漸増させていき、全12週間実施するプログラムです。
表1 ロコモ予防運動プログラムの内容
図2 自体重トレーニングの代表例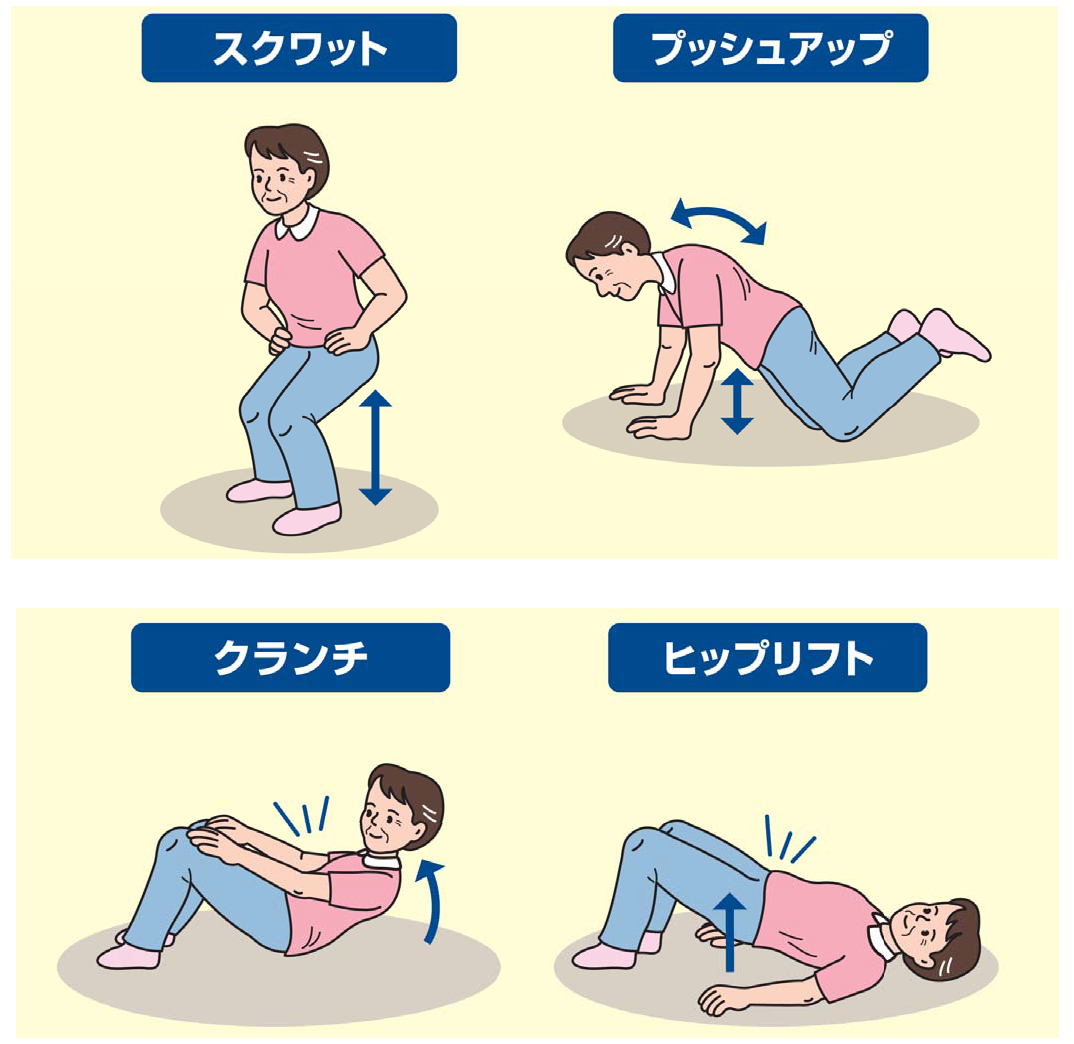
本運動プログラムの効果検証を行うべく、50~70代を中心とする地域住民を対象に週2回の頻度で12週間の運動教室を開催し、開催期間の前後に効果検証のための体力測定を行いました。その結果、上腕部、前腕部、腹部、大腿部における筋厚の有意な増加や、等尺性膝伸展筋力、CS-30、30秒上体起こしテスト、最大歩行速度等の有意な改善が認められ、筋量、筋力、身体機能の改善といった成果が得られることが明らかになりました(Ozakiet al., 2020)。
先に述べたように、日本人高齢者を対象とした先行研究において、加齢に伴う筋量の減少は特に下肢で顕著に生じることが報告されています(安部1995; 谷本 2010)。また、我々は最近、ロコモ(ロコモ度1以上)該当者は、該当しない人と比較し、腹部や大腿部前面の筋厚が有意に薄いことを報告しました(Natsume et al., 2021)。こうした筋量の減少に対して、今回の運動プログラムは有用であることが示唆されます。さらに我々は、ロコモ(ロコモ度1以上)該当者では、該当しない人と比較して血清アルブミンレベルが有意に低く(Yoshiharaet al., 2019)、トレーニング介入前の血清アルブミンレベルが比較的低い場合には運動プログラムに取り組むことで期待されるトレーニング効果が制限されることも報告しました(Sawada et al.,2021)。こうした知見は、ロコモ該当者には栄養状態の悪化が生じていることや、トレーニング効果を適切に得るためには栄養状態の改善が必要であることを示唆しており、運動面と食事面からのアプローチが推奨されているロコモ対策の取り組みとも合致しています(ロコモ チャレンジ!推進協議会, 2020)
「老いは脚から」と言われるように、下肢における骨格筋の筋量・筋力低下は、歩行や日常生活の障害に直結することで高齢期の自立度やQOLの低下をもたらし、要介護のリスクを高める可能性があります。一方、骨格筋の筋量・筋力低下は、筋力トレーニング等の実施によって、年齢を問わず予防・改善が可能であると考えられます。わが国は超高齢社会となりましたが、「ロコモ予防運動プログラム」をはじめとする適切な対策を実践することで、国民の皆様が豊かな人生を歩まれることを願います。
【参考文献】
● Bull FC, et al. Br J Sports Med 2020; 54:1451-1462.
● 安部孝, 福永哲夫. 日本人の体脂肪と筋肉分布, 1995; 杏林書院.
● 東京都立大学体力標準値研究会編. 新・日本人の体力標準値, 2000; 不昧堂出版.
● 町田修一.運動とタンパク質・遺伝子(柳原大, 内藤久士 編). ナップ社;2004; p 80-100.
● Lexell J, et al. J Neurol Sci 1988; 84: 275-94.
● 町田修一ほか. サルコペニアの基礎と臨床(鈴木隆雄 監修). 真興交易医書, 2011; p22-31.
● 町田修一. 老化の生物学(石井直明 編).化学同人,2014; p273-86.
● Frontera WR, et al. J Appl Physiol. 1988; 64:1038-44
● Fiatarone MA, et al. JAMA. 1990; 263: 3029-34.
● 宮地元彦ほか. 日本老年医学会雑誌 2011; 48: 51-54.
● Ozaki H, et al. J Sports Sci Med 2020; 19: 721-726.
● 谷本芳美ほか.日本老年医学会雑誌 2010; 47: 52-57.
● Natsume T, et al. J Sports Sci Med 2021; 20: 635-641.
● Yoshihara T, et a: BMC Musculoskelet Disord 2019; 20: 104.
● Sawada S, et al. BMC Geriatrics 2021; 21: 464
● 公益社団法人 日本整形外科学会、ロコモ チャレンジ!推進協議会:ロコモパンフレット2020年度版. 2020
▼町田講師の講演を動画でご視聴いただけます。
本公開講座の内容をまとめた冊子(講演集)を販売しております。詳細は老年学公開講座講演集のページをご参照ください。
PDF版では更に多くの写真などをフルカラーで掲載しております、是非併せてお読みください。