国立障害者リハビリテーションセンター研究所運動機能系障害研究部分子病態研究室と、東京都健康長寿医療センター、シンガポール国立大学などとの共同研究グループは、運動で生じる骨への「力(衝撃)」が、力を感知する分子として知られているタンパク質(Cas:キャス)に作用し、身体の多くの組織・臓器の炎症※1・老化に関与することが知られている別のタンパク質(NF-κB:エヌ・エフ・カッパ・ビー)の活性を抑制することで骨の強度・密度を維持するメカニズムを発見しました。この研究により、Casが適度な運動の健康維持・増進効果を取り持つ"適度な運動タンパク質"として機能すること、および、運動時に身体に加わる衝撃が健康維持・増進に重要であることが、その背景となる分子の仕組みと共に明らかとなりました。本成果は、『Science Advances』2019年9月25日発行号に掲載されました。
特に高齢者で見られる、骨量低下状態すなわち骨粗鬆症※7は、大腿骨頚部骨折など生命維持に影響を与える可能性があるケガの原因となるばかりか、認知機能障害などさまざまな身体機能低下につながり、健康寿命をおびやかすことが明らかとなっています。運動が骨粗鬆症の予防・治療に極めて重要であることはわかっていましたが、運動が骨の健康を維持する仕組みはよく分かっていませんでした。
また、骨に限らず、運動は身体のほとんどすべての臓器・組織において炎症・老化を抑制する効果があることはわかっていましたが、その仕組みもよく分かっていませんでした。
本研究の意義は、適度な運動の健康維持・炎症抑制効果を取り持つタンパク質、すなわち「適度な運動タンパク質」の発見と、そのタンパク質の機能が組織液の流動で制御されるということの発見です。「適度な運動タンパク質」の機能あるいは組織液の流動を操作・制御することによる骨粗鬆症さらには全身の臓器の機能低下の治療・予防法の開発につながります。さらには、どんな運動を1 日どのくらい、1週間に何日行えば、健康維持、抗老化になるのかといった健康寿命延伸へ向けた重要な問題の解決にもつながるものです。今回の研究の成果からは、1日10分間の運動で骨に衝撃を与えることが、骨、さらには身体の健康維持に役にたつ可能性が考えられます。
本研究は「日本学術振興会科学研究費助成事業」および「文部科学省私立大学戦略的研究基盤形成支援事業」からの支援を受けて行われました。
超高齢社会を迎えた日本のみならず、先進諸国においては、社会の継続的かつ健全な発展と医療経済という観点から、健康寿命の延伸が喫緊の課題となっています。ほとんどの加齢性の疾患・障害に「適度な運動」が有効であること統計的に証明されています。しかし、適度な運動の「適度」はきちんと定義されていないのが実状です。それどころか、運動の何が身体の好影響を与えるかすら、ほとんど分かっていません。例えば有酸素運動が有効と言われていますが、本当に「有酸素」が重要なのか、分かっていません。運動・エクササイズの健康維持効果に関する情報の氾濫という現況につながっています。また、骨・関節など運動器官の障害により運動したくても運動できない方は、運動による健康維持効果を享受できないのでさらなる身体機能低下を負うことになります。加齢に伴う身体不活動や、肢体不自由障害による身体運動の不足・制限によって、筋萎縮・糖代謝障害(糖尿病)・心血管障害などの二次障害が起こるにもかかわらず、有効で副作用の少ない治療法が確立されていないことは大きな問題です。
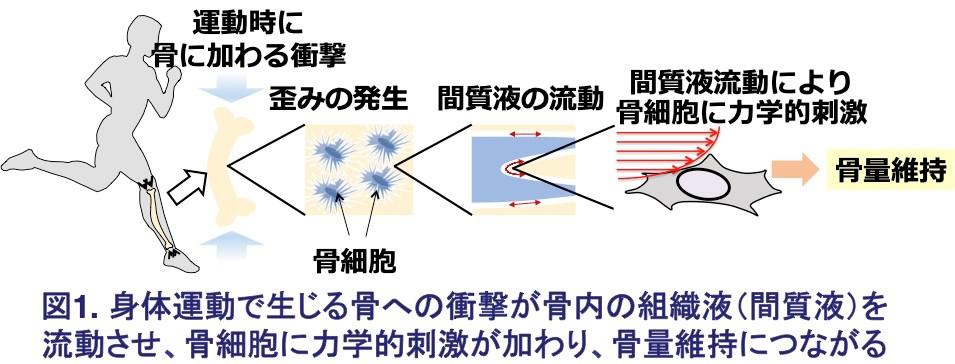
近年、多くの加齢性疾患や生活習慣病に炎症が関与することが明らかにされています。そこで、研究チームは、骨の健康維持効果における運動の本質が、運動時に骨に加わる力(衝撃)であることを明らかにし、その衝撃で生じる骨内の組織液の流動による骨細胞における炎症の抑制や抗老化の作用を分子レベルで検証しました。
(1)歩行あるいは走行で生じる骨への衝撃が、骨細胞における炎症・老化促進タンパク質の活性を抑制し、骨量を維持することを確認
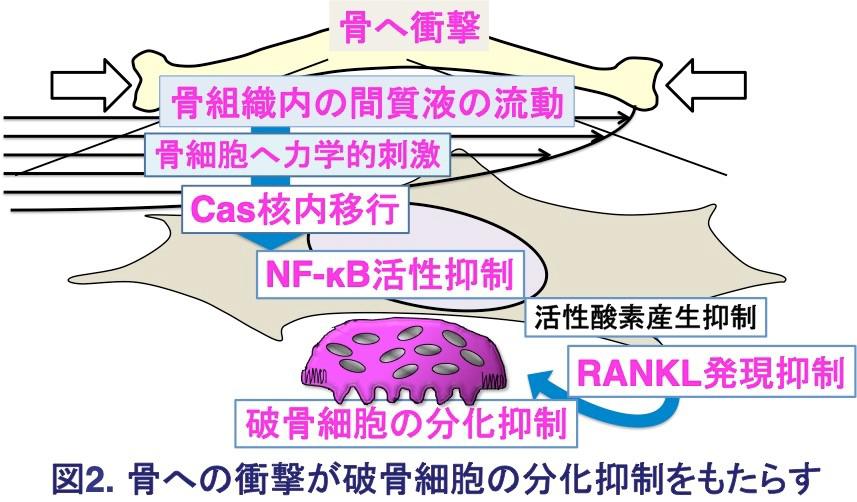
マウスの片方の後肢の神経を切離し、歩いた(走った)時のその側の後肢の骨への衝撃を減弱して、神経を切離していない後肢の骨と比較したところ、神経切離した後肢では骨量が減少し、骨細胞におけるNF-κB活性化とCasの核外分布が認められました。これは、骨への衝撃によりCasが核内に分布し、NF-κB活性が抑制されることを示します。
(2)骨に衝撃を与えた時に起きるCasの核内分布とNF-κB活性低下を培養細胞で再現
骨に衝撃を与えた時に生じる骨内組織液の流動により骨細胞に加わる力を培養細胞で再現したところ、Casが核内に分布し、NF-κB活性が抑制され、骨吸収(骨破壊)細胞である破骨細胞の分化を促進するタンパク質であるRANKLの発現が低下しました。
(3)Casが欠失した骨細胞を持つマウスでは骨量が減少
骨細胞のCasが欠失したマウスの後肢の骨は、神経切離した後肢の骨と同様にNF-κB活性が促進され、RANKLの発現が増加し、骨破壊が亢進していました。
(4)CasがNF-κB活性を抑制する仕組みの解明
培養細胞を使った実験で、Casは核内でNF-κB活性を促進する酵素と結合することで、その酵素がNF-κB 活性を促進することができないようにすることを明らかにしました。
(5)骨細胞においてCas欠失で生じる骨量低下は、NF-κBも欠失させると救済される
骨細胞のCasが欠失したマウスの骨に較べ、CasもNF-κB も欠失したマウスの骨では骨量が増加していました。これは、Casによる骨量維持効果はNF-κB 活性の抑制を介していることを示します。
今回の研究内容を図1及び図2にまとめました。
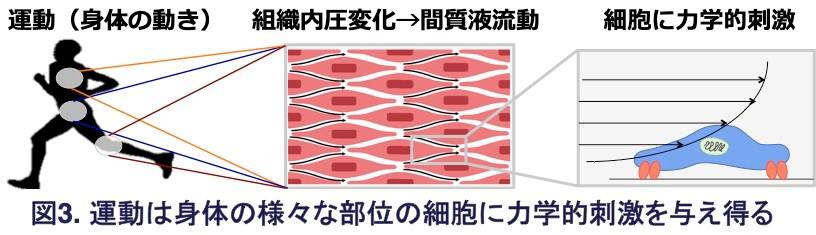
CasもNF-κBも、また間質液も、全身のどの組織・臓器においても存在します。今回、骨への衝撃の効果を検証しましたが、骨以外の組織においても、「間質液流動→細胞に力学的刺激→Casが核内に分布→NF-κBの活性抑制」という分子の仕組みが、運動の炎症抑制・抗老化効果に関与していることが考えられます(図3)。今回の研究は、間質液の動きを促進することが健康維持法としての運動の本質であり、「運動ってなんだ」という問いへの答えにつながるとともに、運動したくても運動できない障害を持つ者にも適用可能な擬似運動治療法の開発につながる可能性が見いだせました。
※1 炎症:従来は、外傷や細菌感染などにより生じる発赤 (ほっせき)、熱感、腫脹、疼痛を特徴する急性の生体現象とされてきた。しかし、近年、炎症の概念が大きく変わり、糖尿病などの生活習慣病や認知障害などの加齢性の慢性疾患に、炎症が深く関与することが明らかとされている。
※2 Cas:電気泳動上の分子量からp130Casとも呼ばれるタンパク質。本研究グループの澤田らが、細胞が力(力学的刺激)を細胞内の生化学的反応に変換する分子(メカノセンサー)として報告した。今回の研究により、「適度な運動」の効果を伝える分子、すなわち"適度な運動タンパク質"であることが明らかとなった。
※3 骨細胞:骨組織における細胞の90%以上を占める細胞。近年までその役割が不明であったが、最近、骨に加わる物理的な刺激を感知して、骨の形成と吸収を制御するという重要な役割を果たしていることが明らかとされている。
※4 NF-κB:遺伝子に結合し、多くの炎症促進に作用するタンパク質(炎症性タンパク質)の産生に関与することで炎症反応制御において中心的な役割を果たすことが知られているタンパク質。
※5 破骨細胞:骨を吸収(破壊)する細胞。骨を形成する(造る)細胞が骨芽細胞であり、破骨細胞による骨吸収と骨芽細胞による骨形成のバランスにより骨量の増減が決まる。
※6 間質液:組織・臓器の実質以外の部分は間質、間質に存在する体液(組織液)は間質液と呼ばれる。間質液は、細胞外液のうち血管内を流れる血液とリンパ菅の中を流れるリンパ液を除く液体であり、量は血液の4倍を占め、細胞外液としては圧倒的に最大である。
※7 骨粗鬆症:骨の量(骨量)が減って骨が弱くなり、骨折しやすくなる病気。特に高齢(閉経後)の女性では、年齢に相応した状態でも骨粗鬆症となることがある
雑誌名:Science Advances
論文タイトル:Mechanical regulation of bone homeostasis through p130Cas-mediated alleviation of NF-κB activity(p130CasによるNF-κB 活性抑制を介する骨恒常性の物理的制御)
著者:宮崎剛1、Zhao Zhihai2、市原克則5、吉野大輔6、今村武史5、澤田圭祐2, 7、早野暁8、上岡寛8、森秀一1、平田宏聡2、荒木啓吾2、川内敬子2、重本和宏1、田中栄9、Lynda F. Bonewald10、本田浩章11、篠原正浩3、長尾元史3、緒方徹3、原田伊知郎7、澤田泰宏3,4 (人名の後の数字は、所属機関)
1東京都健康長寿医療センター研究所
2シンガポール国立大学メカノバイオロジー研究所
3国立障害者リハビリテーションセンター研究所
4国立障害者リハビリテーションセンター病院
5鳥取大学医学部薬理学・薬物療法学
6東北大学学際フロンティア研究所
7名戸ヶ谷病院名戸ヶ谷研究所
8岡山大学大学院医歯薬学総合研究科歯科矯正学
9東京大学大学院医学系研究科整形外科学
10インディアナ大学医学部
11東京女子医科大学実験動物研究所
論文公開URL: https://advances.sciencemag.org/content/5/9/eaau7802
公開号:第5巻9号(2019年9月25日発行号)
論文番号(DOI):10.1126/sciadv.aau7802