当センター神経病理学研究チームは、東京都医学研究所認知症プロジェクトの長谷川成人プロジェクトリーダー、英国MRC Laboratory of Molecular BiologyのMichel Goedert, Sjors Scheresグループリーダーらとの共同研究により「パーキンソン病とレビー小体型認知症のαシヌクレイン線維構造の同一性」について、2022年9月15日に英国科学雑誌「Nature」に発表しました。なお、高齢者ブレインバンクが高品質リソース提供において大きな貢献をしました。
"Structures of α-synuclein filaments from human brains with Lewy pathology"
「パーキンソン病とレビー小体型認知症のαシヌクレイン線維構造の同一性」
英国科学雑誌「Nature」
DOI:https://doi.org/10.1038/s41586-022-05319-3
URL:https://www.nature.com/articles/s41586-022-05319-3
MRC分子生物学研究所の神経生物学部門のMichel Goedert博士と構造研究部門のSjors Scheres博士のグループは、長年の共同研究を基に、電子低温顕微鏡法(クライオ電子顕微鏡)を用いて、パーキンソン病とレビー小体型認知症の脳から採取したαシヌクレイン線維の構造を決定しました。この線維の形成は、神経細胞の変性やこれらの疾患の症状を引き起こすと考えられています。
パーキンソン病 (PD) は最も一般的な運動障害であり、安静時振戦、硬直、運動緩慢、および姿勢の不安定性が主な症状です 。神経病理学的には、黒質のドーパミン作動性神経細胞を含む一部の脳細胞に、レビー小体およびレビー神経突起の形で α-シヌクレインの豊富な繊維状封入体が存在することを特徴としています。PD は、認知機能低下が最も一般的な非運動症状の 1 つである多系統障害としてますます認識されるようになっています。多くの PD 患者は、診断から 10 年以上経過して認知症を発症します。PD認知症 (PDD) は、臨床的および神経病理学的にレビー小体型認知症 (DLB) に類似しており、認知障害がパーキンソン運動症状に先行するか、発症から 1 年以内に始まる場合に診断されます。PDD では、十分に確立された PDの設定で認知障害が発生します。 PDと DLB に加えて、多系統萎縮症 (MSA) は 3 番目の主要なシヌクレイノパチーです。これは、脳細胞、特にオリゴデンドロサイト (Papp-Lantos body) に豊富な繊維状 α-シヌクレイン封入体が存在することを特徴としています。我々は以前に、MSA 患者の脳から抽出された 2 種類のα-シヌクレインフィラメントの電子クライオ顕微鏡 (cryo-EM) 構造を報告しました。各フィラメント タイプは、2 つの異なるプロトフィラメントでできています。ここでは、PD、PDD、および DLB を持つ個人の脳からの α-シヌクレイン フィラメントの低温電子顕微鏡構造が、MSA のプロトフィラメントとは著しく異なる単一のプロトフィラメント (レビー フォールド) でできていることを報告します。これらの発見により、神経変性疾患における組み立てられたα-シヌクレインの異なる分子配座異性体の存在を確立されました。
今後、PETのリガンドを作成するのに役立つ可能性があること、病的な蓄積物の詳しい構造が明らかとなったことで、創薬に結び付くことが期待されます。
本研究は、ヒト試料を用いた研究ですが、ほとんどが当センターのブレインバンクをはじめとする日本のブレインバンクから提供された検体で行われました。本邦のブレインバンクの高品質検体提供が国際評価を受けていることの裏付けとなったことを意味する重要な成果です。
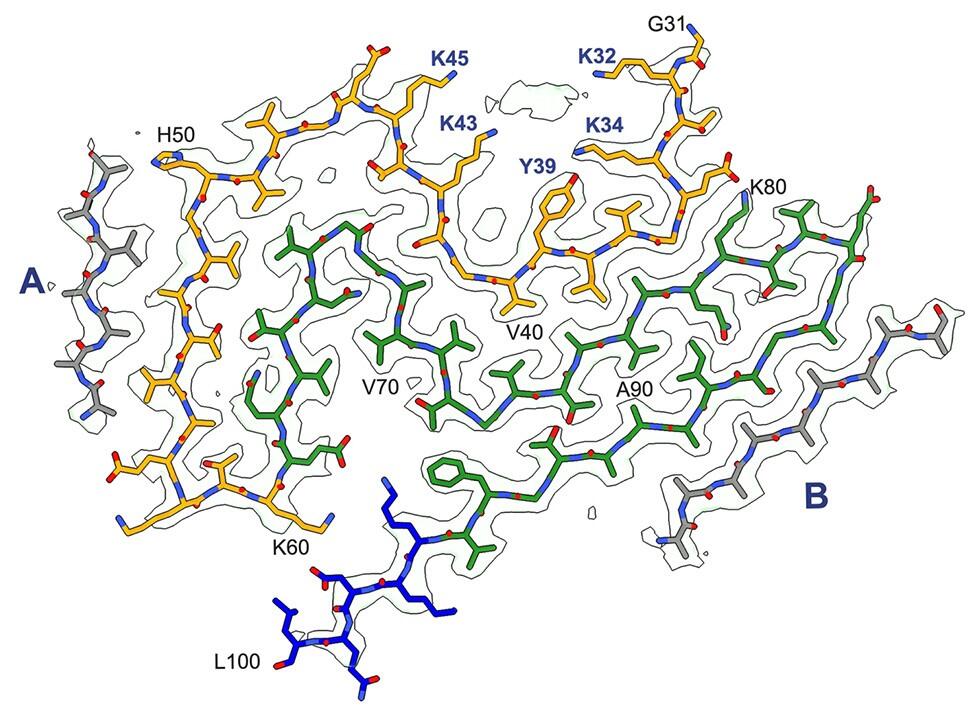
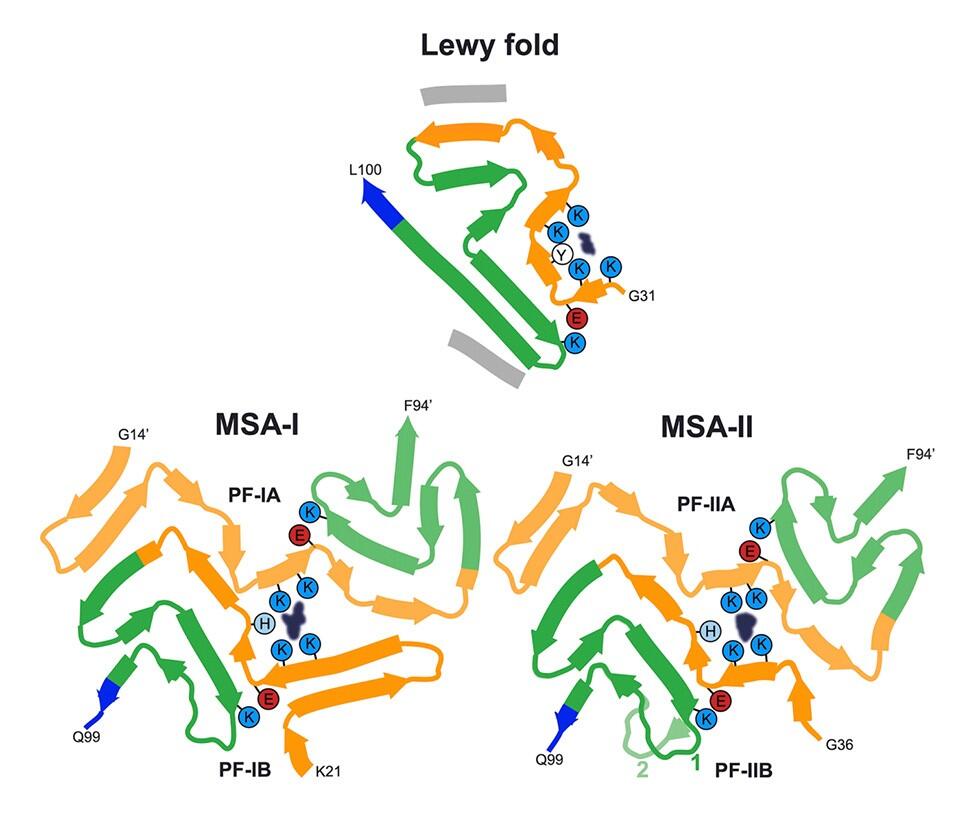
クライオ電顕によるレビー小体の密度マップと原子モード レビーおよび多系統萎縮症 (MSA) フォールドの二次構造要素
(参考)これまでに上記共同研究団体への検体提供により、Natureへの投稿があった論文一覧
※本研究は、UKRI MRC、Alzheimer's Research UK、National Institute for Health Research Queen Square Biomedical Research Unit in Dementia、Rita Lila Weston Institute for Neurological Studies、科学技術振興機構(CREST)、日本医療研究開発機構(AMED)、米国国立衛生研究所、Indiana University School of Medicine病理・検査医学科から資金援助を受けました。