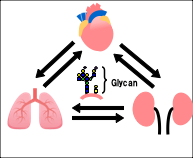メンバー
| リーダー |
研究副部長 豊田 雅士 |
|---|
| 研究員 |
佐々木 紀彦、板倉 陽子、大瀬 賢介(認知症未来社会創造センター) |
|---|
| 非常勤研究員 |
吉田 友里香 |
|---|
| 研究生 |
大学院生1名、卒研生3名 |
|---|
キーワード
心血管病、老化、血管、糖鎖、組織再生
主な研究
1.心臓組織の機能維持と加齢変容に関する研究
2.血管機能に関する研究
3.心臓組織機能の維持・再生に関する研究
研究紹介
高齢者の増加や昨今の新型コロナウイルス感染症の流行に伴い、心不全や呼吸不全患者が今後急増する、「心不全・呼吸器不全パンデミック」になることが予測されています。こうした懸念に応えるため、私たちは心血管系の加齢性疾患の発症機序の解明につながる基礎研究に取り組んでいます。
組織は、加齢に伴って機能が低下する「老化」が起こります。この組織機能の低下は、私たちのからだの健康に影響を及ぼし、疾患リスクを高めていきます。私たちは、心臓血管系疾患が発症するに至る前段階で起こる小さな変化を捉える研究に取り組んでいます。また低下してしまった機能を再生させる試みにも挑んでいます。疾患発症へとつながる組織機能の低下を早期に見出すことで適切な診断・治療、また高齢者の生活の質を確保した負担のかからない新たな再生医療へとつがることを目指しています。
1.心臓組織の機能維持と加齢変容に関する研究
私たちの体は多種多様な細胞から構成され、生命が維持されている限りその「細胞社会」による統合的制御が続けられます。1つ1つの細胞は生き物であり、そこにも寿命があります。機能を果たせなくなった細胞は、多くの場合除去されます。そうすると個体の機能を維持するために直ちに修復が行われています。しかしこうした修復を繰り返す中で、元の状態に戻るのに時間がかかったり、不十分だったりして、元の機能を維持できない「老化」がおこり、その蓄積が疾患へとつながっていくと考えられています。
心臓組織も多くの種類の細胞で構成されています。ポンプ機能を果たす心臓の中で中心的に機能しているのは心筋細胞です。この心筋細胞は、ある時期より分裂・再生することなく一生涯働き続けると考えられています。その周囲では心筋細胞を補佐している線維芽細胞や血管由来の細胞により心臓は絶え間なく機能しています。私たちは、この心筋細胞を軸とした多彩な細胞群が織りなす心機能が加齢とともにどのように役割を変え、組織としての機能を維持しているかを、様々な視点で解析しています。特に翻訳後修飾としてタンパク質に付加される糖鎖の機能に着目し、加齢に伴う構造変化とそれに伴う機能変化を通して、心臓を構成する細胞群が織りなす社会の制御機構を調べています。心臓組織内では時空間的な分子の変化が生じています。例えば心臓の外側付近と内側付近では時間の経過(加齢)とともにシアル酸と呼ばれる糖鎖が減少するという構造の変化が生じていました(図1) (Itakura Y, et al. Biogerontology, 2021)。このような分子の変化が加齢や疾患においてどのような意義をもたらすかが重要なカギとなると考えています。
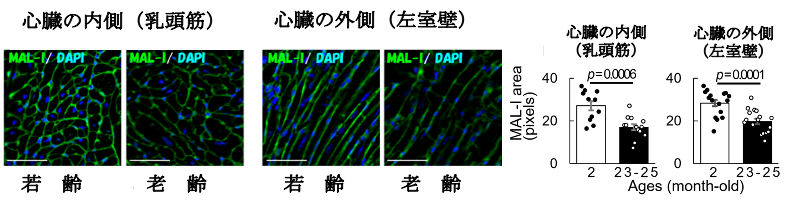
図1.心臓の領域に応じた糖鎖(シアル酸)の変化
心臓は常時拍動し続けるために多大なエネルギーを必要とし、その産生を担うために心筋細胞の内部に多量のミトコンドリアを保持しています。しかし、ミトコンドリアはエネルギー産生の過程で発生する酸化ストレスによって障害され、徐々に機能が低下します。心筋細胞では、障害されたミトコンドリアを細胞内の様々な経路で分解することで細胞全体のミトコンドリアの品質を維持していますが、これらの経路の一部が加齢により働きにくくなることが示唆されています。私たちは、ミトコンドリア分解経路の加齢変化を解析して、それが発端となる心臓の機能低下の仕組みについて研究しています。
2.血管機能に関する研究
全身に張り巡らされた血管は、組織に酸素や栄養を供給し機能維持に重要な役割を果たしています。「ヒトは血管とともに老いる」と言われ、組織機能の低下が血管機能に深く関与していると考えられますが、その詳細な機序についてはよくわかっていません。しかし、私たちは近年の研究で、マウスの心臓組織内の毛細血管が加齢に応じて減少傾向にあることを示しました(Itakura Y, et al. Regen Ther, 2023)。そこで、血管の加齢や血管を構成する内皮細胞や平滑筋細胞の老化に伴う動的変化に着目して研究を進めています。特に血管の内皮機能が老化に伴って生じる影響を、その細胞膜上の糖脂質や糖タンパク質の機能的変化として捉え、炎症・再生に伴う血管リモデリングで起こる分子機構について解析を行っています(Sasaki N, et al, Front Cell Dev Biol, 2022; Sasaki N, et al, Cell Commun Signal, 2020; Sasaki N, et al, Stem Cell Res Ther, 2017)。さらに、血管機能の変化が周辺細胞を介して組織機能にどの程度、またどのように影響を与えているかを検討しています。老化に伴う心血管病の発症から重症化に至る過程での心血管系の細胞間ネットワーク機構の解明を目指しています(図2)。
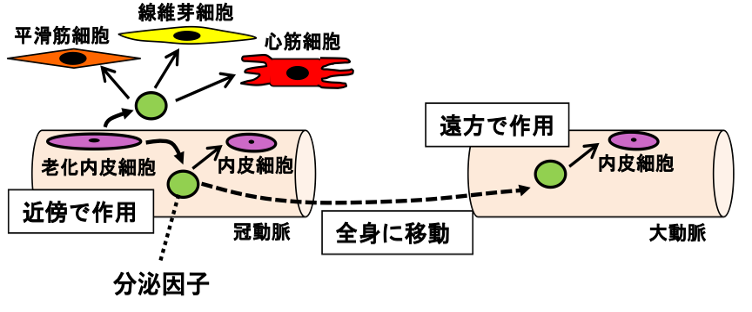
図2.心血管ネットワーク:内皮細胞の老化による影響
また、組織内の相互作用にとどまらず、近年では血管を介して臓器と臓器の相互作用に着目し"臓器連関"における加齢との関連性を調べています。ヒトが生きる中で心臓と周辺臓器との関連性は切っても切り離せません。特に心臓と直接血管で連結されている肺への影響や心臓機能の低下を知らせるマーカーを分泌する腎臓における変化は、血管との関りが大きいと予想されます(図3)。加齢と病態との関連性を明らかにするために、細胞社会だけではなくこのようにもう少し大きな「臓器社会」における糖鎖の役割を明らかにすることを目指しています。
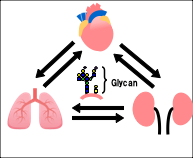
図3.臓器連関における糖鎖の役割
3.心臓組織機能の維持・再生に関する研究
低下した心臓機能を再生させる研究が近年著しい進展を見せています。人工臓器を活用した治療、増殖能と分化能を有する幹細胞(多能性幹細胞-ES細胞、iPS細胞-・様々な組織に存在する組織幹細胞-造血幹細胞、間葉系幹細胞、神経幹細胞など-)による幹細胞移植医療(いわゆる再生医療)は、基礎研究からすでに臨床研究の段階まできています。しかし高齢者にとってこれら治療を受けるには、複合的な疾患を抱えていることを考慮する必要性があり、また侵襲性を伴うことのリスクを考えることが求められるなどかなりハードルが高いのが現状です。
私たちは、高齢者の生活の質を落とすことなく心臓機能を維持するための模索を行なっています。また高齢者にとって負荷をかけずに低下をした心臓機能を再生させることにもチャレンジしていきたいと考えています。
関連情報
研究所ホームページ「研究トピックス」(日本語)
日本語総説
- 佐々木紀彦、板倉陽子、豊田雅士.「老化関連疾患の予防、治療法の開発に向けた『老化と糖鎖』」,生化学会誌,90(5):719-723, 2018.
- 豊田雅士. 「血管の老化と慢性炎症」, 別冊BIO Clinica (北隆館), 10(2): 25-30, 2021.
- 佐々木紀彦. 「(カラーグラビア)老化と糖鎖研究」, 別冊BIO Clinica (北隆館), 10(2): 1-5, 2021.
- 佐々木紀彦. 「細胞老化と糖鎖」, 基礎老化研究誌(日本基礎老化学会), 46(1):23-31, 2022.
主要文献(英語論文)
- Itakura Y, Hasegawa Y, Kikkawa Y, Murakami Y, Sugiura K, Nagai-Okatani C, Sasaki N, Umemura M, Takahashi Y, Kimura T, Kuno A, Ishiwata T, Toyoda M. Spatiotemporal changes of tissue glycans depending on localization in cardiac aging. Regen Ther 22:68-78, 2023.
① https://doi.org/10.1016/j.reth.2022.12.009
② 研究所ホームページ「研究成果」(日本語)
③ https://www.tmghig.jp/research/release/2023/0111.html
- Sasaki N, Hirano K, Shichi Y, Itakura Y, Ishiwata T, Toyoda M. PRC2-dependent regulation of ganglioside expression during dedifferentiation contributes to the proliferation and migration of vascular smooth muscle cells. Front Cell Dev Biol 10:1003349, 2022.
① https://doi.org/10.3389/fcell.2022.1003349
② 研究所ホームページ「研究成果」(日本語)
③ https://www.tmghig.jp/research/release/2022/1018.html
- Nagai-Okatani C, Zou X, Matsuda A, Itakura Y, Toyoda M, Zhang Y, Kuno A. Tissue glycome mapping: lectin microarray-based differential glycomic analysis of formalin-fixed paraffin-embedded tissue sections. Methods Mol Biol, 2460:161-180, 2022. https://doi.org/10.1007/978-1-0716-2148-6_10
- Itakura Y, Sasaki N, Toyoda M. Glycan characteristics of human heart constituent cells maintaining organ function: relatively stable glycan profiles in cellular senescence. Biogerontology 22(6):623-637, 2021.
① https://doi.org/10.1007/s10522-021-09940-z
② 研究所ホームページ「研究成果」(日本語)
③ https://www.tmghig.jp/research/release/2021/1111.html
- Sasaki N, Itakura Y, Mohsin S, Ishigami T, Kubo H, Chiba Y. Cell Surface and Functional Features of Cortical Bone Stem Cells. Int J Mol Sci 22:11849, 2021.
① https://doi.org/10.3390/ijms222111849
- Sasaki N, Toyoda M, Ishiwata T. Gangliosides as signaling regulators in cancer. Int J Mol Sci 22(10):5076, 2021. (Review)
① https://doi.org/10.3390/ijms22105076
- Kosugi M, Otani M, Kikkawa Y, Itakura Y, Sakai K, Ito T, Toyoda M, Sekita Y, Kimura T. Mutations of histone demethylase genes encoded by X and Y chromosomes, Kdm5c and Kdm5d, leads to noncompaction cardiomyopathy in mice. Biochem Biophys Res Commun, 525(1):100-106, 2020.
① https://doi.org/10.1016/j.bbrc.2020.02.043
- Sasaki N, Itakura Y, Toyoda M. Rapamycin promotes endothelial-mesenchymal transition during stress-induced premature senescence through the activation of autophagy. Cell Commun Signal, 18(1):43, 2020.
① doi: 10.1186/s12964-020-00533-w
② 研究所ホームページ「研究成果」(日本語)
③ https://www.tmghig.jp/research/release/2020/0313.html
- Sasaki N, Toyoda M. Vascular diseases and gangliosides. Int J Mol Sci, 20(24), E6362, 2019. (Review)
① https://doi.org/10.3390/ijms20246362
- Sasaki N, Itakura Y, Toyoda M. Gangliosides contribute to vascular insulin resistance. Int J Mol Sci, 20(8):1819, 2019. (Review)
① https://doi.org/10.3390/ijms20081819
- Iso Y, Usui S, Toyoda M, Spees JL, Umezawa A, Suzuki H. Bone marrow-derived mesenchymal stem cells inhibit vascular smooth muscle cell proliferation and neointimal hyperplasia after arterial injury in rats. Biochem Biophys Rep,16:79-87, 2018.
① https://doi.org/10.1016/j.bbrep.2018.10.001
- Nishino K, Arai Y, Takasawa K, Toyoda M, Yamazaki-Inoue M, Sugawara T, Akutsu H, Nishimura K, Ohtaka M, Nakanishi M, Umezawa A. Epigenetic-scale comparison of human iPSCs generated by retrovirus, Sendai virus or episomal vectors. Regenerative Therapy, 9:71-78, 2018.
① https://doi.org/10.1016/j.reth.2018.08.002
- Itakura Y, Sasaki N, Toyoda M. Qualitative and quantitative alterations in intracellular and membrane glycoproteins maintain the balance between cellular senescence and human aging. Aging (Albany NY), 10(8):2190-2208, 2018.
① https://doi.org/10.18632/aging.101540
- Miura Y, Hashii N, Ohta Y, Itakura Y, Tsumoto H, Suzuki J, Takakura D, Abe Y, Arai Y, Toyoda M, Kawasaki N, Hirose N, Endo T. Characteristic glycopeptides associated with extreme human longevity identified through plasma glycoproteomics. Biochim Biophys Acta, 1862(6):1462-1471, 2018.
① https://www.sciencedirect.com/science/article/pii/S0304416518300874?via%3Dihub
- Sasaki N, Itakura Y, Toyoda M. Ganglioside GM1 contributes to extracellular/intracellular regulation of insulin resistance, impairment of insulin signaling and down-stream eNOS activation, in human aortic endothelial cells after short- or long-term exposure to TNFα. Oncotarget, 9(5):5562-5577, 2018.
① http://www.oncotarget.com/index.php?journal=oncotarget&page=article&op=view&path%5B%5D=23726
- Sasaki N, Itakura Y, Toyoda M. Sialylation regulates myofibroblast differentiation of human skin fibroblasts. Stem Cell Res Ther, 8(1):81, 2017.
① https://www.ncbi.nlm.nih.gov/labs/articles/28420408/
- Zou X, Yoshida M, Nagai-Okatani C, Iwaki J, Matsuda A, Tan B, Hagiwara K, Sato T, Itakura Y, Noro E, Kaji H, Toyoda M, Zhang Y, Narimatsu H, Kuno A. A standardized method for lectin microarray-based tissue glycome mapping. Sci Rep, 7:43560, 2017.
① https://www.nature.com/articles/srep43560
- Tateno H, Saito S, Hiemori K, Kiyoi K, Hasehira K, Toyoda M, Onuma Y, Ito Y, Akutsu H, Hirabayashi J. α2-6sialylation is a marker of the differentiation potential of human mesenchymal stem cells. Glycobiology, 26(12):1328-1337, 2016.
① https://academic.oup.com/glycob/article-lookup/doi/10.1093/glycob/cww039
- Itakura Y, Sasaki N, Kami D, Gojo S, Umezawa A, Toyoda M. N- and O-glycan cell surface protein modifications associated with cellular senescence and human aging. Cell Biosci, 6:14, 2016.
① http://cellandbioscience.biomedcentral.com/articles/10.1186/s13578-016-0079-5
- Ojima T, Shibata E, Saito S, Toyoda M, Nakajima H, Yamazaki-Inoue M, Miyagawa Y, Kiyokawa N, Fujimoto J, Sato T, Umezawa A. Glycolipid dynamics in generation and differentiation of induced pluripotent stem cells. Sci Rep, 5:14988, 2015.
① http://www.nature.com/articles/srep14988
- Sasaki N, Itakura Y, Toyoda M. Ganglioside GM1 contributes to the state of insulin resistance in senescent human arterial endothelial cells. J Biol Chem, 290:25475-25486, 2015.
① http://www.jbc.org/content/290/42/25475.long
② http://biomedfrontiers.org/diabetes-obesity-2016-12/