がんは中高年の三大死因であり、特に50歳代から60歳代では死因の約半数に達します。従来、がんを克服すれば寿命が大幅に延長できると期待されてきました。しかし本年初め、遺伝子を操作して作り出されたマウスを使った実験が報告され、がんを抑制する遺伝子として有名な「p53」が活性化すると、発がんは著明に抑制されますが、寿命が短くなることが報告されました(参考文献-1)。発がんが抑制されても寿命は延長しないようなのです。
哺乳動物では、p53と呼ばれる遺伝子がDNAの障害を検出する機構と、DNAを修復する機構を橋渡す機能を持っています。一般的に動物の細胞は母親と父親由来の同じ機能を持つ遺伝子を一対持っています。P53遺伝子に関しては、マウスでもヒトでも、通常p53遺伝子を一対持つので、p53+/+と表記されます。ところがヒトのがん症例の過半数にこの遺伝子に変異や欠損のあることがわかりました。特に、遺伝子変異によってp53遺伝子が機能を失うと、がん化する頻度が著しく上がることから、ヒトでもp53はがん抑制に重要な関わりを持つと考えられています。
Aという遺伝子の一対を人為的に除いたり、違うものに置き換えることにより、その遺伝子を持たないマウスを、Aのノックアウトマウスと言い、遺伝子型A-/-と表記します。P53遺伝子のノックアウトマウス(遺伝子型p53-/-)は若いうちにほぼ全例でがんが発生し早死にします。このことから、p53はがん抑制遺伝子であることが証明されたのです(Donehowerら、1992)。
この実験もDonehowerという研究者らのグループが行ったのですが、p53遺伝子のごく小さな部分に突然変異を導入することを計画して実験していたところ、意図に反し偶然に、p53遺伝子が広範に欠損したマウス(専門的に言いますと、カルボキシル基側半分だけの異型p53タンパクが発現したマウスで、その遺伝子型をp53mと記します)を見つけました。正常(野生型という)マウスのp53遺伝子とこの変異p53遺伝子を両方持ったマウス(p53+/m)では、野生型(p53+/+)よりp53遺伝子が強く働いており、腫瘍の発生が6%以下とほぼ完全に抑制されます(図1)。ちなみに、片方のp53遺伝子が欠損し、もう一方に変異p53遺伝子を持ったマウス(p53-/m)は、p53が完全に欠損したマウス(p53-/-)と同様、早期にがんを100%発症し、短寿命であることがわかりました。野生型でも腫瘍発生率は高く、45%以上となっています。これらの実験結果から、p53遺伝子が変異してもp53mだけでは発がんを抑制する機能はありませんが、野生型のp53遺伝子が同時に存在すると、発がんを抑制すると推測されます。
ところがこの変異マウス(p53+/m)の生存率を検討したところ、驚くべきことに、早くから多彩な老化症状(早老症状:肝臓・脾臓・腎臓・筋肉・皮膚の萎縮、脊椎後曲、骨粗鬆症、毛髪の再生困難や傷の治りにくさ、等)が現れ、野生型マウス(p53+/+)に比べ、明らかに寿命が短くなっていたのです (図-1,参考文献-1)。
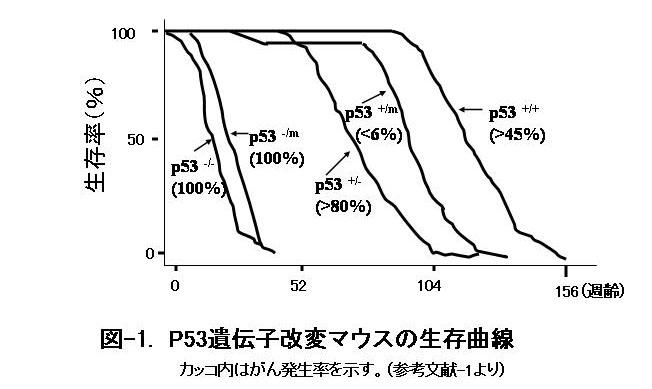
がんはマウスにおいても主要な死因です。がんの発生を抑制すれば、寿命が延びてもよさそうなのに、がんが抑制されると早老症状を示し短命となりました。この皮肉ともいえる結果をもたらした原因はまだ明らかになっていませんが、Donehowerらは、p53が働くと、体のいろいろな組織で幹細胞(分裂能と分化能を持ち、組織や臓器を維持・再生する能力をもった細胞)の機能が低下するために、その組織が維持できなくなり萎縮するのではないかと述べています。p53の活性化によりDNAの変異がより効率的に修復され、DNA傷害に起因する腫瘍発生が抑制される一方で、p53が過剰に活性化すると、DNA傷害を受けた幹細胞の増殖を過度に抑制するか、あるいは過剰なアポトーシス(細胞死)を起こし、全身組織をバランスのとれた状態にする機能が早期に失われ、早老症状をもたらした可能性があります。
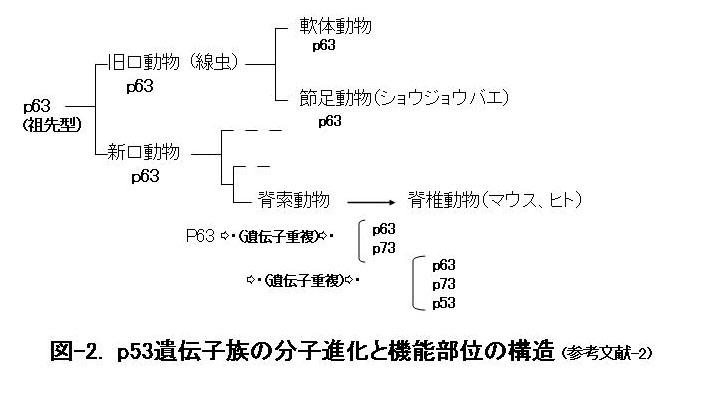
がん抑制遺伝子として注目される哺乳動物のp53の遺伝子族には、現在3種(p53, p63, p73)あることが知られています。動物分類学のうえで生物進化の祖先型をとどめると考えられる線虫やショウジョウバエなどの旧口動物ではp63のみ、旧口動物より進化した新口動物ではp63のみを有する祖先種から遺伝子重複によりp73とp53が生じたと推定されています(図ー2)。
p53遺伝子族の中で最初に登場したと考えられるp63にはいろいろな働きがありますが、その最も根元的な機能は幹細胞の働きを保つことで、幹細胞は上皮系臓器(消化器や呼吸器や肝臓など)や骨などを作り維持するのに必要不可欠だと考えられています。一方、進化的に後から誕生したとされるp53遺伝子は、強力なDNA修復機能によりがん抑制遺伝子としての働きを獲得したものと考えられます(参考文献-2)。今回の実験は、これらの遺伝子がバランスよく機能することが重要なことを示唆しています。このp53変異マウスが示す早老現象は、変異遺伝子p53がp63と相互作用してその機能を阻害した結果による可能性も考えられます。
この実験は、長寿を達成するために重要な要素と考えられるがん抑制と老化現象抑制に関して、p53が"両刃の剣"となることを示しました。確かに健康長寿を達成することの難しさを示すものですが、悲観することではないと考えます。この実験から示唆されたポイントとして、第一に、がんと老化に共通する根本原因であるDNAの傷害を起こさせない(p53を発動させない)ことの重要性が示された点が挙げられます。第二に、がん治療の戦略として既に認識されていることですが、がん細胞を特異的に殺しながら、幹細胞は保存する方法を確立することの大切さが挙げられます。がん化と老化の関連を新たな切り口から見直し、がん制圧・老化抑制戦略に新たな展開がもたらされることを期待したいと思います。