人の体は40~60兆個もの細胞が集まって作られています。腫瘍とは、この中の1個の細胞が周囲の環境に影響されることなく自律的に、無制限に増え続けてしまうものです。腫瘍には悪性腫瘍(がん)と良性腫瘍があり、その違いはがん転移(転移)がおこるかどうかです。最初にがん細胞が発生した臓器(原発巣)から、がん細胞は血管やリンパ管に侵入して他の臓器に到達し、そこで再び増殖し大きながんの塊を形成します。がんが肺に転移すると息苦しくなったり、肝臓に転移すると胆汁が排泄できなくなって黄疸がでたりするなど、各臓器が本来、担っている働きができなくなってしまいます。さらに病状が進み、体の中の多数の臓器に転移がおこると多臓器不全となって生命を脅かされることになります。一方で、良性腫瘍は転移をおこさず最初に発生した臓器で大きくなるため、大部分は手術などで完治することができます。
膵臓がんで亡くなられた患者さんの病理解剖では、がんの原発巣は小さくても膵臓周囲のリンパ節や肝臓、肺に多数の転移を認められる方が多くおられます。膵臓がんの転移を抑えることができれば、良性腫瘍のように原発巣を手術で摘出できる可能性が高まると考え、私達は転移抑制の研究をしています。
細胞の働きに中心的な役割を果たすタンパク質は、ヒトでは約10万種類あると考えられています。細胞の核に存在する染色体のDNA(デオキシリボ核酸)の一部には遺伝子と呼ばれるタンパク質の設計図となる情報が含まれています。遺伝子の情報は、メッセンジャーRNA(リボ核酸)に伝えられ(転写)、その後でタンパク質が作られます(翻訳)。一方で、RNAの一部はタンパク質に翻訳されることなく機能し、非コードRNA(ノンコーディングRNA)と呼ばれています。非コードRNAにはRNAからタンパク質の翻訳に必須の転移RNA(トランスファーRNA)やリボソームRNAがあることが知られていましたが、近ごろは翻訳以外の様々な細胞の機能に関与するRNAが存在することがわかってきました。特にRNAの長さが200塩基以上の長鎖非コードRNAは、細胞の分化やがん化などに関与することが明らかになり、注目されています(参考文献1)。
① 転移巣ではH19が増加しており、転移を促進している
同じ膵臓がん患者さんのがん細胞でも、それぞれのがん細胞は性質が異なっており、細胞の形や産生するタンパク質を変化させることができることがわかってきました。私達は転移先の臓器で増えている膵臓がん細胞は原発巣のがん細胞と比べ転移をしやすくするような物質を多く作り、転移に利用しているのではないかと考えて研究を始めました。最初に膵臓がん患者さんから樹立されたヒト膵臓がん培養細胞株を免疫不全マウスに移植し、 マウスの肺に転移したヒト膵臓がん細胞を分離し「肺転移由来ヒト膵臓がん細胞株」を樹立しました(参考文献2)。マウスに最初に移植した膵臓がん細胞と、「肺転移由来ヒト膵臓がん細胞株」の RNA を網羅的に比較したところ、長鎖非コード RNA のH19 が全てのRNAの中で2番目、非コードRNAの中では最も(約80倍)肺転移細胞株で増加していました。次に膵臓がん患者さんの 手術で得られた組織を検討したところ17%の患者さんで、がん組織にH19 が増加していました。そこでH19を減少させたヒト膵臓がん培養細胞をマウスに移植すると、肝転移と肺転移を著明に抑制することができました(図1、白色の結節が転移)。これらのことから、ヒト膵臓がん患者さんのがん細胞に発現しているH19を抑制することが、新たな膵臓がんの治療法になる可能性があることを解明しました。
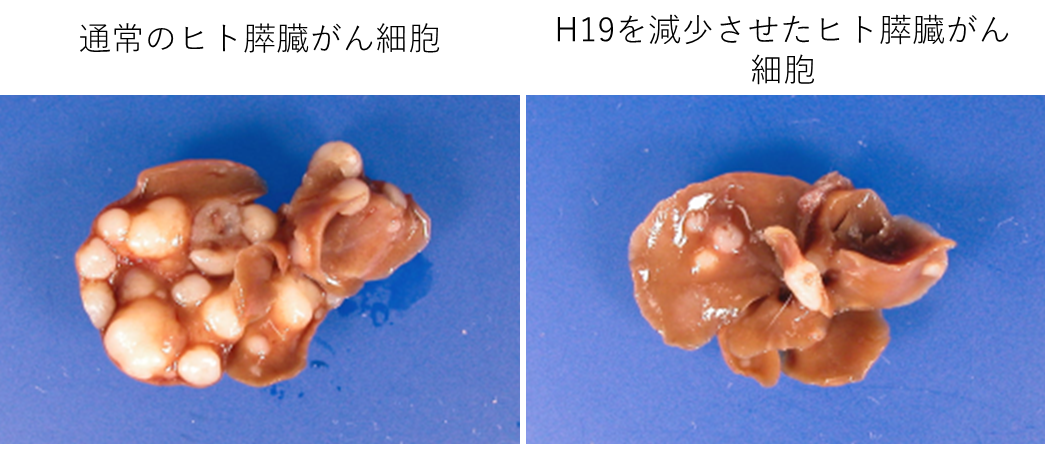
図1.ヒト膵臓がん細胞のマウス肝臓への転移
➁ H19はどのように膵臓がんの転移を促進しているのか?
膵臓がん細胞で産生されるH19がどのような機序や経路によって、がんの転移を促進しているのかを知ることができれば、それらを標的とした新たな転移抑制治療法の開発につながる可能性があります。
私達の研究では、H19が膵臓がん細胞のインテグリン(細胞膜上に発現している接着分子)発現を促して細胞外基質に接着させ、MMP(細胞外基質を分解するタンパク質の一種)などでこれらの基質を分解し浸潤や転移を促進させることが明らかになりました(参考文献3)。
最近の研究では、低接着プレートで培地内に立体的に培養した3次元(3D)培養で形成されるヒト膵臓がん培養細胞株では、がんの治療抵抗性や転移に関係すると考えられている幹細胞が多く含まれ(幹細胞様細胞)、シグナル伝達系の1つであるgp130/STAT3経路が活性化していました(参考文献4)。そこで膵臓がんの、がん幹細胞様細胞に gp130阻害剤を添加しgp130/STAT3経路を阻害すると、増殖抑制、幹細胞マーカーやMT1-MMPの低下がみられ、がん細胞の浸潤能が抑制されました。gp130/STAT3経路は、がん幹細胞様細胞のトランスフォーミング増殖因子(TGF)β-受容体IIの発現を維持することにより、上皮間葉転換(epithelial-mesenchymal transition/EMT:運動能の高い間葉系細胞への転換はがんの転移に深く関わると言われている)に関わることが明らかになりました。さらに、gp130/STAT3経路が、がん幹細胞様細胞のH19発現に関与しており、クロマチン免疫沈降法(分子生物学的手法の1つで、タンパク質とゲノム間の相互作用がわかる)によって、リン酸化-STAT3がH19のプロモーター領域(RNAに転写させるための目印となるゲノム領域)にアクセスしてH19の転写に寄与することを解明しました(図2)。これらから、gp130/STAT3経路の阻害はH19の発現を抑制し転移を抑えると考えられ、膵臓がんの新たな治療法となることが期待されます。
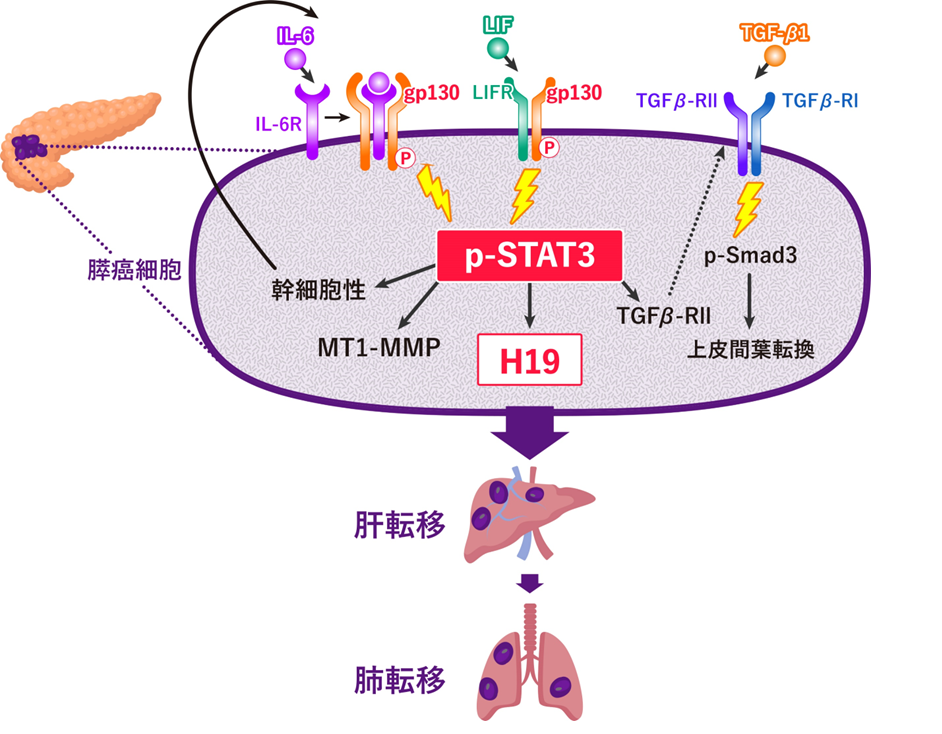
図2.ヒト膵臓がん細胞のH19による転移促進のメカニズム
膵臓がんの5年生存率は約10%で、この25年間で数%しか向上しておらず、他のがんの平均5年生存率の約60%を大きく下回っています。顕微鏡でみると大部分の膵臓がんは腺がんで、前立腺がんや乳がん、胃がん、大腸がんなどと同じ組織型に分類されます。膵臓がんは他の腺がんと何が異なっているのか、なぜ他のがんで有効な抗がん剤が効きにくいのかなど不明な点が未だに多くあります。膵臓がんの特徴を明らかにして正体をはっきりさせることと、膵臓がんの転移を抑えるなど今までとは違う新たな視点からの治療法の開発が不可欠です。
膵臓がんは大部分が成人に発症し、高齢者を中心に近年、増加しています。喫煙や過度の飲酒などの生活習慣や、糖尿病などの生活習慣病が膵臓がんにかかりやすくなる危険因子として知られています(参考文献5)。
膵臓がんにかからないような生活を高齢者に送って頂くとともに、難治性の膵臓がんに対する今までとは違った新たな有効な治療法の開発を目指して研究を続けています。