2023.6.1
人口の高齢化に伴い現在の日本ではがん患者が増えています。がんでお亡くなりになる割合も死因として最も多いです。がんに対しては通常手術による根治を目指しますが、進行した状態で発見されることも多く、手術が困難であれば抗がん剤を用いた化学療法、ホルモン剤を用いた内分泌療法、放射線治療、免疫療法などの治療法を選択することになります。研究の進歩に伴いこれらの治療法による予後の改善も見込まれるようになりましたが、当初効いていた治療が効かなくなる治療抵抗性のがん細胞の出現により治療が困難になります。別の治療薬を用いるものの限定的な効果であり、さらなる治療法の出現が求められています。
現在の日本で注意が必要ながんは何でしょうか?胃がんはがんによる死因のトップでしたが、診断、治療法の進歩で患者数、死亡者も減少傾向です。また肝臓がんについても減少しています。代わって男性のかかるがんとして最も患者数が多いのは前立腺がんです(図1)。特に高齢の男性に発症する割合が高く高齢男性に要注意の病気と考えられます。幸い検診で発見可能で早期に診断されると救命される可能性も高いですが、患者数の急増や進行した状態で見つかることも多いため死亡者も急増しています。死者数の多い肺がん、大腸がん、膵臓がんと並んで男性が注意すべきがんと言えます。
前立腺がんは男性ホルモンであるアンドロゲン(図2)により悪性化が進行すると知られています。「ホルモン療法」とよばれる男性ホルモンを抑える治療が前立腺がんの治療法として有効ですが、治療を継続すると薬剤が効かなくなり、再発、難治化して死に至ることが大きな課題です。再発した場合に第2、第3のホルモン療法薬や抗がん剤を使用しますが、さらに進行したがんに変化することにより死に至ると言われています。このようながんの性質の変化の仕組みを調べることが治療法の確立につながると考えられています。
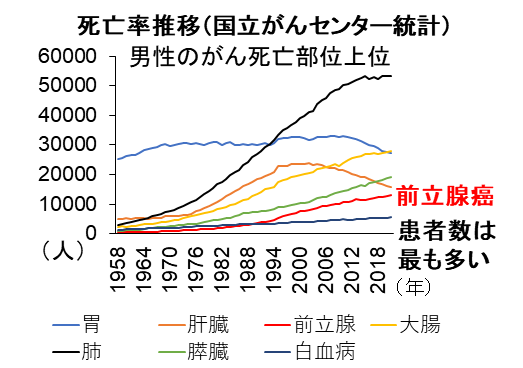
図1.超高齢社会におけるがん死の増加
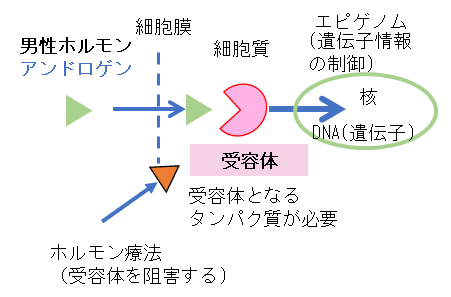
図2.男性ホルモンの働く仕組み
細胞の性質を決定する最も重要な器官は細胞の中心にある核です。核の中にはDNAと呼ばれる遺伝情報が詰め込まれており、そこから必要な情報を読み細胞の働きに重要なタンパク質を作る指令を出しています。遺伝情報を読むためには「転写因子」と呼ばれる種類のタンパク質が働きます。必要な遺伝子の情報を読み込みタンパク質が作成されるためのスイッチを入れているのです。実は悪性化、治療抵抗性に陥ったがんではゲノム(DNA配列)自体が変化していることもわかっています。例えばp53と呼ばれるがんを抑制する転写因子は悪性度の高いがんで遺伝情報の変異が起き正常に働いていない、欠損している割合が増えることがわかっています。一方でスイッチ役の転写因子の異常増加が起きることでもがんが変化します。男性ホルモンアンドロゲンの受容体であるアンドロゲン受容体(AR)はホルモン療法に抵抗性を獲得したがん細胞で異常に増えることがわかっています。ARの遺伝情報が書いてあるDNAが局所的に増幅する、あるいは遺伝情報が読まれやすくなっている環境の変化が主な原因です。我々はこのような転写因子の増幅に着目して研究を進めました。
私たちは東京大学医学部付属病院の泌尿器科の先生がたと共同で実際に治療抵抗性になり転移を起こした前立腺がんの組織の一部を入手しました。CTスキャンにより画像で腫瘍を映し出しながら針を刺して組織を入手する、あるいは亡くなったご遺体の組織を頂くなどの方法で集めました。一方で転移していないまだ治療が初期段階の前立腺がん組織を手術で切除した組織から入手しました。同時にがん化していない組織も切除標本より入手しました。これら3群を比較してどの遺伝子が変化しているかを網羅的に解析することに成功しました(文献1)。その結果治療抵抗性のがんに特異的に活性化される遺伝子のグループが見えてきたのです。このデータを用いて私たちは転写因子に着目して遺伝子の解析を行いました。その結果OCT4と呼ばれる遺伝子に着目しました。
OCT4は細胞が未分化な初期状態(いわゆるiPS細胞)になるために必須の遺伝子です。OCT4ががんの悪性化にどのように関わっているのか、その仕組みの解析を行いました。その結果、OCT4は前立腺がんで鍵となるARを中心とするタンパク質群と複合体を形成してがんが悪性化するような遺伝子の活性化を広くコントロールしていることが分かったのです(図3)。さらに興味深いことにホルモン療法が効かない、抗がん剤も効かない最終的な状態ではARが発現しなくなることがわかっていますが、OCT4はそのようながん組織においては別の転写因子NRF1と会合していることがわかりました。このNRF1との複合体は抗がん剤の耐性に重要なDNA修復に関係している一群の遺伝子を制御していました(図4)。このように転写因子間の複合体形成が新たなネットワークを生むことが抗がん剤への耐性の獲得につながっていることを明らかとしました(文献2)。
さらに重要な転写因子の複合体を形成する仕組みを阻害することでがんの治療につながることが予想されます。近年、海外より転写因子のタンパク質について「相分離」の性質を持ちやすいという画期的な発見がなされました(文献3)。「相分離」とは均一な混合物からの2つの区別できる相が生成される物理現象です。 身近にも相分離はよく観察されます。例えば油と水のような2つの非混和性の液体間には相分離がおき油滴が形成されます。サラダドレッシングを振った時を想像してみてください。このときの分子間の力の偏りにより相が分離します。細胞の中で相分離が起きるとどうなるでしょうか?タンパク質が細胞内に拡散せず一部に集中した集合体を形成するようになります。一部に濃縮するためより効率よく働くようになるのです。
私たちはOCT4の増加がARやNRF1を中心とする複合体の相分離を高めることを示しました。さらに相分離を起こすことにより集合体の形成能を高め、細胞内ではがんを悪性化する遺伝子の情報を読み解く機能を高めていました。かつウイルスの増殖を抑える核酸アナログと呼ばれる種類の薬剤である「リバビリン」を用いることでこれらの集合体の形成を弱める(図4)ことが見出されました(文献2)。そのためリバビリンはOCT4が高く発現しているがんに対して抗がん剤の効きを良くする作用を持つことも示されています(文献4)。
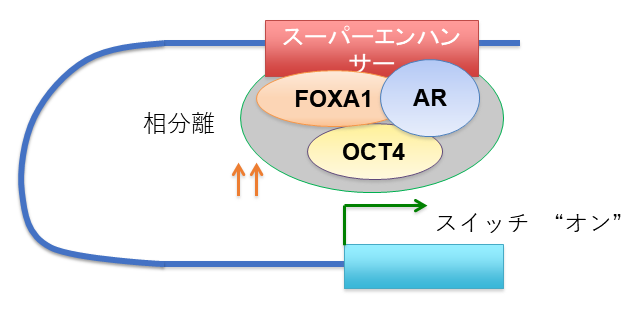
図3.遺伝子のスイッチを入れるOCT4の仕組み
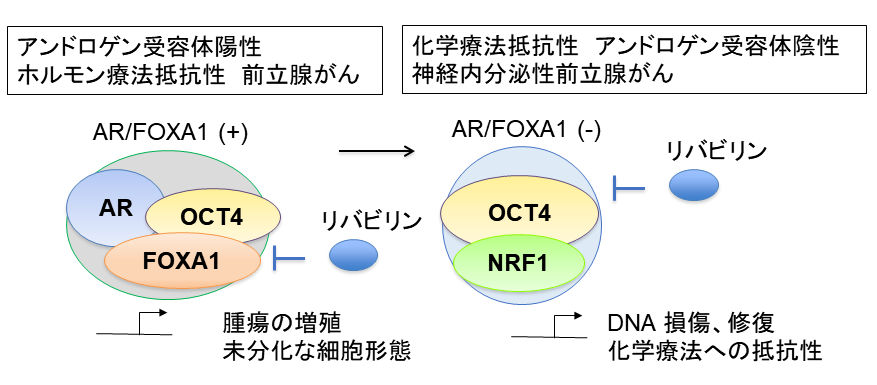
図4.転写因子の複合体形成は病態特異的に変化する
本研究によりいくつもの転写因子が相分離を利用して集合する能力を高め、遺伝子の情報をより読み解りやすくしている仕組みが明らかとなりました。これは細胞内での生物学的に重要な意味があると思われます。またOCT4を中心とした転写因子の集合体の形成を促す相分離という物理化学現象を抑制することをがん治療に応用できること、特に抗がん剤が効かなくなったタイプのがんにおいて治療の標的になることが示されました。最近、前立腺がん以外のがん種でもこのような相分離を標的としたがん治療の可能性について報告がいくつかなされています(文献5)。治療抵抗性に至ったがんの新たな治療法の確立へ道を開く一つの方向性になると考えられます。