2023.7.4
脳は運動や感覚、認知機能など、さまざまなはたらきを担う重要な臓器です。また脳のはたらきを支える上で、脳血流は適切に調節される必要があります。血液の通り道である血管の状態を調べるために色々な方法が用いられてきました。これまでに、顕微鏡やビデオカメラなどで脳表面の血管の様子が観察されてきましたが、脳はお豆腐のように白く濁っているため、従来の方法では脳の中の血管を調べるのは困難でした。近年の科学・技術の発展により新たなイメージング装置が開発され、脳血管のはたらきをより詳細に調べられるようになってきました。この研究トピックスでは、新たなイメージング技術を用いることで見えてきた脳血管のはたらきについてご紹介致します。
健康な成人の脳は約1.4kgの重さがあり、体重60kgのヒトでは全体重の2%に相当します。脳はグルコース(ブドウ糖)をエネルギー源として使い、からだ全体で消費するエネルギーの約20%を消費します(文献1)。しかし、脳ではエネルギー源の蓄えが極めて少ないため、脳は絶えず血流によりエネルギー源を供給される必要があります。それゆえ安静時でも、脳は心臓が送り出す血液量の約15%を受け取っています。すなわち、脳は体重の2%ほどの重さを占める臓器に過ぎませんが、非常に多くのエネルギーを消費し、たくさんの血液を常に必要とする臓器なのです。
血液は心臓のポンプ作用により全身へと送り出されます。脳へは首の骨の中を通る椎骨動脈と喉元を通る内頸動脈(左右2本ずつ、計4本)を通って血液が送られます。これらの動脈は頭蓋内で脳の表面を走行し、枝分かれしながら脳全体に拡がります(脳表動脈)。脳表動脈はさらに枝分かれして、脳の深部(実質内)に入っていき、血液を脳の組織に送ります(実質内動脈)。なお、椎骨動脈と内頸動脈は頭蓋内でつながっているため、これらの血管のうち1本が仮に閉じてしまったとしても、ほかの動脈から血液供給を融通してもらうことで完全に血流が途絶えることがないような構造になっています。
脳組織に送られる血液の量(脳血流量)は、主に血圧と血管の幅(内径)により決まります。動脈など比較的大きい血管には、筋肉(平滑筋)が含まれているため、血管は縮んだり拡がったりすることができます。そのため、脳血管はその幅を変えることで、脳血流を調節するはたらきを担っているのです。
イメージング技術というのは、見たいもの(観察対象)を見て分かるようにする技術です。例えば、X線撮影や血管造影撮影では骨や血管の状態を知ることができますし、ポジトロン断層撮影などでは脳のはたらきを調べることもできます。
私たちは多光子顕微鏡という特殊な顕微鏡を使って研究をしています。通常、観察対象を固定などの処理をしてから観察しますが、多光子顕微鏡では細胞や組織が生きている状態で且つ深い部分まで観察できるのが通常の顕微鏡と異なる点です。なお、実験では観察対象に蛍光物質をくっつけて、レーザーで蛍光物質を光らせて観察するのですが、この顕微鏡ではレーザーが観察対象のより深部まで到達するため、通常の顕微鏡よりも深い場所を観察することができるのです(図1A左)。この特性を生かすと、脳実質内の血管の幅が変化する様子をリアルタイムに観察することが可能です(図1A右)。
またこの顕微鏡のもうひとつの特徴は、複数の物質を異なる蛍光物質で染め分けて同時に観察ができるということです。アルツハイマー病は認知症の原因となる病気で、アミロイドベータというタンパク質が脳内に過剰に溜まることが引き金となって起こると考えられています。アルツハイマー病の患者さんの脳では、神経細胞の周りにアミロイドベータが蓄積するほか、血管壁にも蓄積していることが報告されています。そこで私たちは、多光子顕微鏡を用いて、アルツハイマー病のネズミの脳を観察しました。脳血管とアミロイドベータを異なる蛍光試薬で染め分けて観察したところ、アルツハイマー病のネズミの脳では、人間のアルツハイマー病と同様に、脳実質内や脳表動脈周囲にアミロイドベータが蓄積していることが分かりました(文献2)(図1B)。
図1.多光子顕微鏡を用いた脳イメージングの例
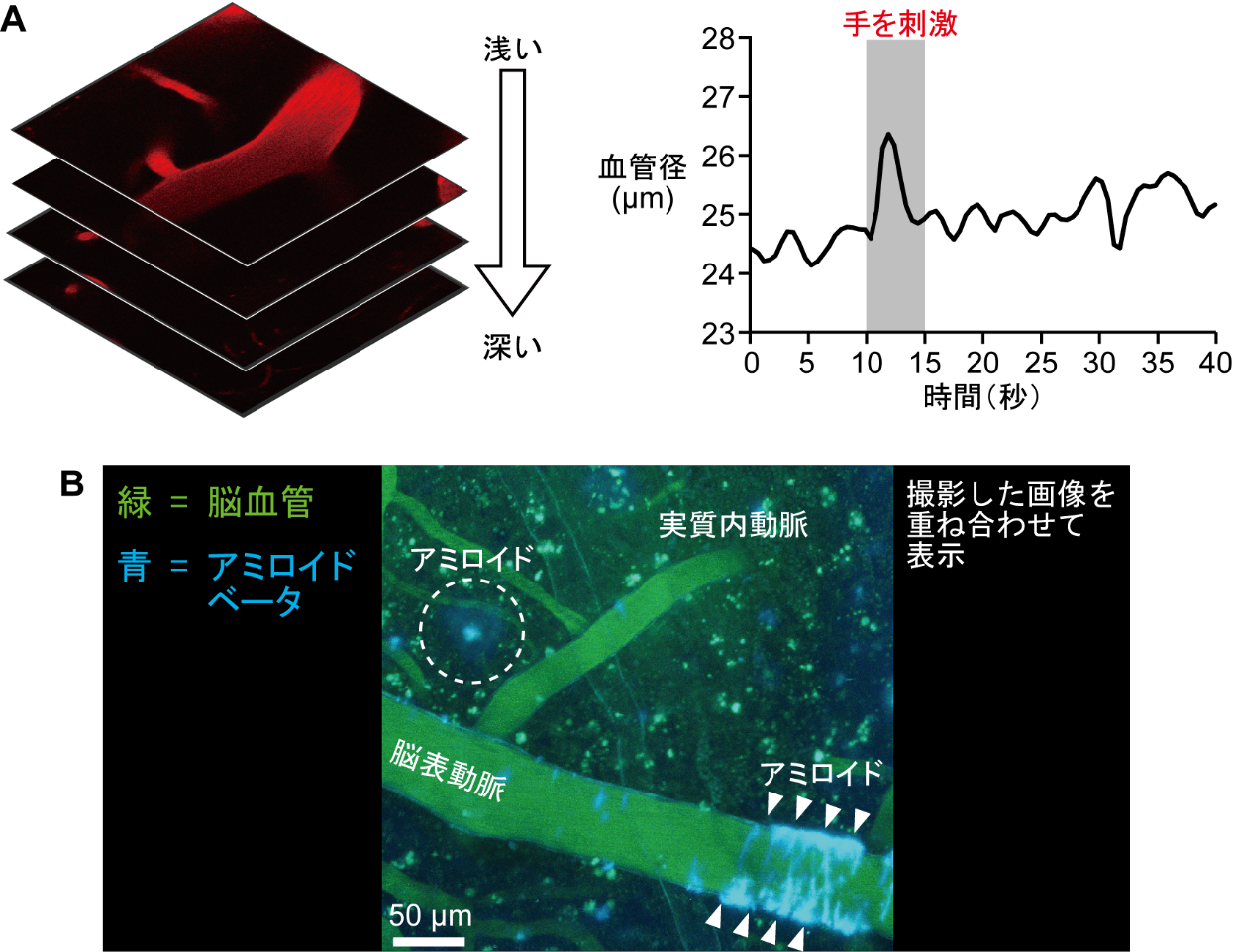
(A)脳深部の血管を連続的にイメージングし、手を刺激したときの実質動脈の直径の変化を観察
(B)アルツハイマー病のネズミの脳血管と蓄積したアミロイドベータを同時に観察
脳は場所ごとに役割が異なります。例えば、目で物を見るときには視覚に関わる場所で神経細胞が働き、音を聞くときは聴覚に関わる場所の神経細胞が働きます。脳(神経細胞)が働いた場所では局所的に脳血流が増えます。このことを機能性充血といいます。麻酔薬で意識を消失させたネズミでも、手を刺激すると手の感覚に関係する脳の部位で血流が増えます(文献3)(図2)。
図2.麻酔したネズミの脳血流画像
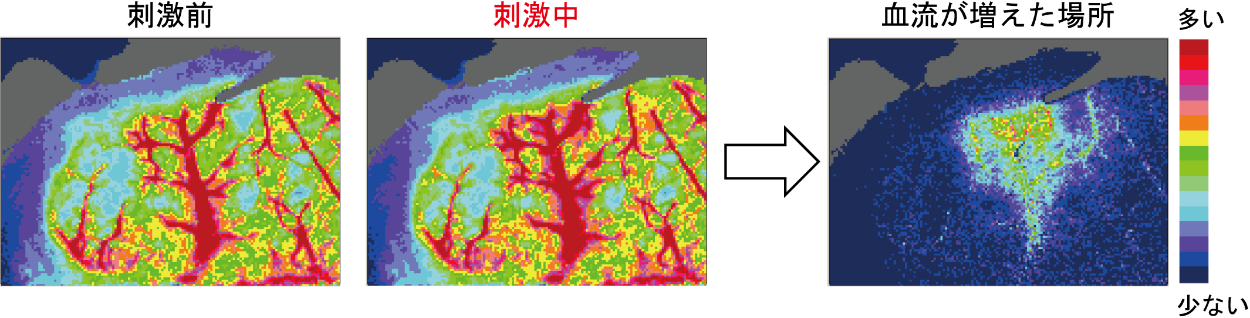
赤いところが血流の多いところ、青いところが血流の少ないところを意味する。
ネズミの手を刺激している最中は、刺激前と比べて赤い場所が増える。図2右側にこれらの画像を差し引きした画像を示す。局所的に血流が増えているのが分かる。
ではこの時、脳の血管はどうなっているのでしょうか?そこで私たちは、多光子顕微鏡でネズミの脳血管をイメージングし、手を刺激したときの変化を調べました(図3)。実験では脳を横断するかたちでイメージングしますので、脳表の動脈は長方形、脳実質内の動脈は円形に見えます。ネズミの手を刺激しますと、刺激前よりも血管の幅(厳密には内径)が拡がっていることが分かりました(文献3)。このようなイメージング研究は世界中で盛んにおこなわれています。他の研究室からの報告と併せますと、手など身体への刺激の情報が脳に伝わると神経細胞が活動し、神経細胞が放出する物質などが脳実質内の動脈を拡張させ、脳血流が増加すると考えられています。さらに、実質内動脈の拡張が脳表動脈に伝わることも分かってきました(文献4)。
図3.多光子顕微鏡を用いた脳血管イメージング実験
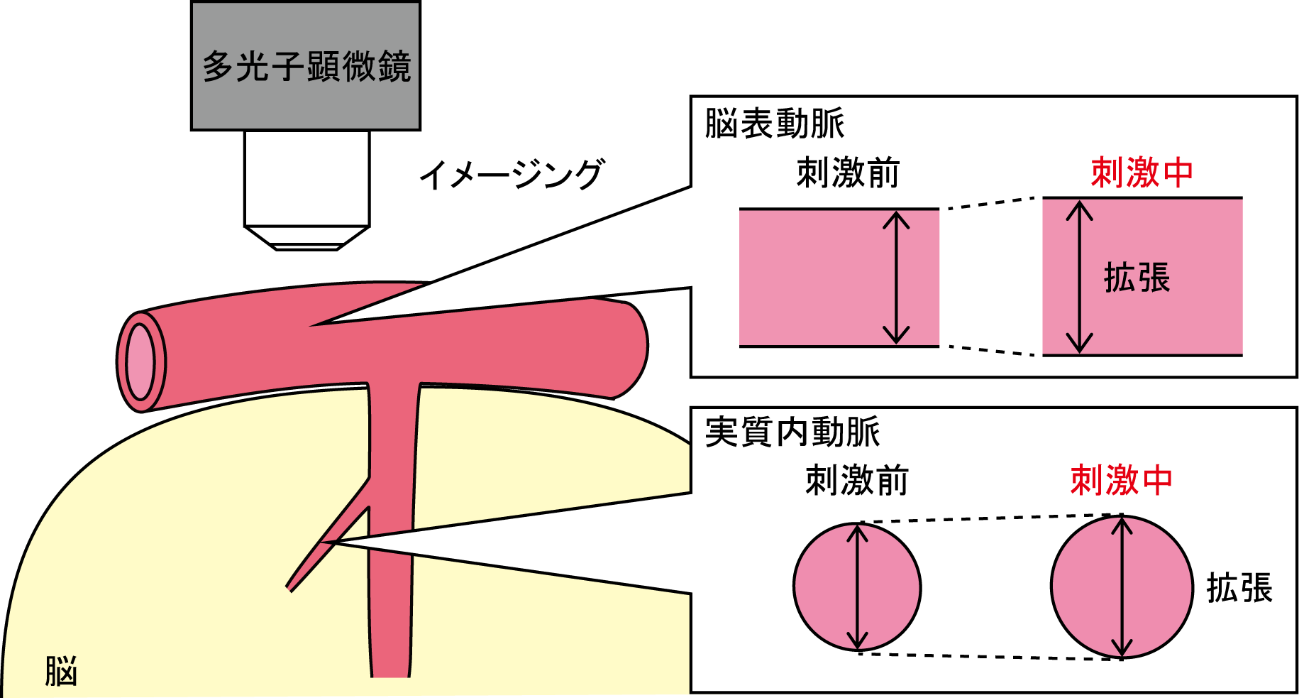
ネズミの手を刺激している最中に脳表動脈も実質内動脈も拡張する。
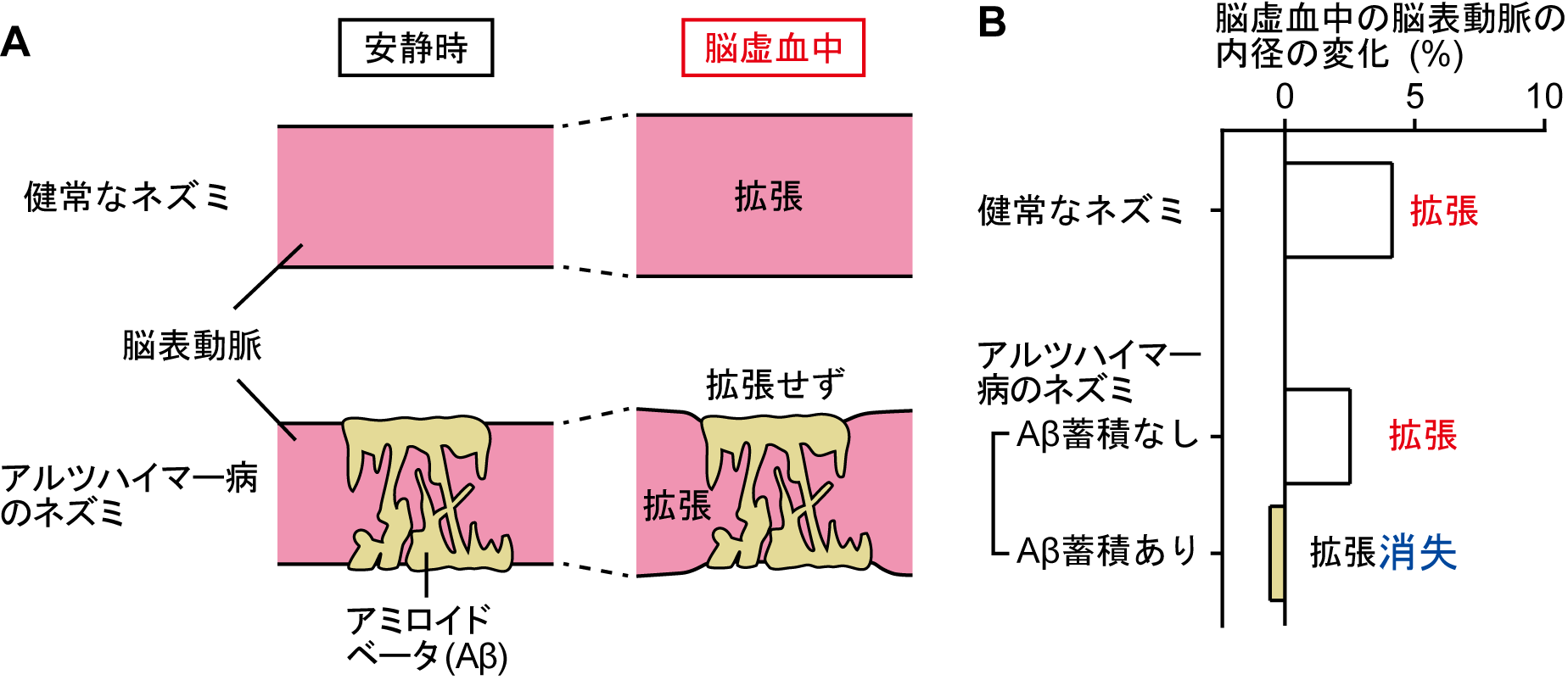
アルツハイマー病の危険因子として肥満や糖尿病などが知られていますが、脳血流を低下させうる疾患もまた、危険因子に含まれています(文献5)。そこで、私たちは、脳血流が低下したとき(脳虚血が起こったとき)に脳血管がどのような反応を示すかを調べました(文献2)。まず健常なネズミの脳を多光子顕微鏡で観察し、片側の頸動脈を閉じて脳虚血を起こしたところ、虚血中に脳表動脈の幅が拡がり、虚血後は速やかに元に戻ることが分かりました(図4A上段)。このことは、血圧(血管にかかる圧)の高低に応じて血管の幅が変化するという性質(自動調節)により生じたと考えられ、虚血中に脳表動脈が拡張することで脳の他の場所から血液の流入を促し、虚血の程度を軽くしているものと推測されます。
続いて、アルツハイマー病のネズミで脳虚血が起こったときの反応を調べました。アルツハイマー病のネズミでは、脳表動脈の一部にアミロイドベータが蓄積していますので、アミロイドベータが蓄積している所と蓄積していない所に分けて解析をおこないました。その結果、アルツハイマー病のネズミでもアミロイドベータの蓄積がないところでは脳表動脈は拡張しましたが、アミロイドベータがあるところでは拡張反応が消失していました(図4A下段, 4B)。つまり、脳血管に蓄積したアミロイドベータは脳表動脈の拡張反応を妨げると考えられます。
図4.脳血管および蓄積したアミロイドベータの模式図(A)と脳虚血中の脳表動脈の内径の変化を示すグラフ(B)
本研究トピックスでは、イメージング実験で見えてきた脳血管のはたらきについて、私たちの研究成果を交えてご紹介致しました。多光子顕微鏡などの新たなイメージング技術が開発されたことにより、それまで調べることができなかった脳血管の調節のしくみが明らかになり研究が大きく進展しました。最近では、身体への刺激で生じる脳血流増加が、脳脊髄液の流れ(脳からの老廃物の排出)に影響することが報告されました(文献6)。日常の何気ない身体への刺激の中には、脳のライフラインである脳血管のはたらきを調節し、脳の健康維持に役立つものが隠されていると考えられます。今後もイメージング技術を活用しながら、脳血管のはたらきを解き明かしていきたいと思います。