私たちが筋力を発揮するためには、脳からの刺激が神経を通じて筋肉に伝達される必要があります。筋肉の動きを指令するために刺激を伝える神経を総称して運動神経といいますが、この運動神経と筋肉のつなぎ目となる部分が神経筋シナプスであり、プレシナプス、シナプス間隙およびポストシナプスの3つの領域で構成されています (図1)。プレシナプスである運動神経の末端部分 (神経終末) には多数のシナプス小胞が含まれており、各々のシナプス小胞にはアセチルコリン (ACh) 分子が刺激の伝達物質として貯蔵されています。脳からの刺激が電気的な興奮 (活動電位) として神経終末に到達すると、シナプス小胞とプレシナプス膜の融合が起こり、シナプス小胞に貯蔵されているAChがシナプス間隙に大量に放出されます。放出されたAChがポストシナプスの筋細胞膜上に存在する受容体 (AChR) に結合すると、ナトリウムイオンがAChRを通って細胞内に流入し、終板電位と呼ばれる電気的な変化が筋細胞膜に生じます。この変化量がある一定の大きさを超えると、活動電位が発生して筋肉が収縮し、力を発揮することができるようになるのです。
ここで注目したいのは、神経筋シナプスはこれらの刺激伝達を効率良く行うことができるように特徴的な構造を有しているということです。ポストシナプス膜にはシナプス襞 (ひだ) と呼ばれる細かい窪みが多数存在していますが、AChRが主にシナプス襞の頂上部に存在しているのに対し、活動電位を発生させる電位依存性ナトリウム (Na) チャネルはシナプス襞の先端 (底辺) 部に存在しています (図1)。細長い襞構造は刺激を増幅させる作用があるため、AChRの存在するシナプスの頂上部で生じた脱分極がシナプス襞を伝播して先端部に到達する頃には、Naチャネルを開口できるような大きな刺激となるのです。さらに、放出されるAChと効率良く結合するため、AChRは運動神経終末の直下に高密度で凝集しています。そのため、神経終末の直下から離れた領域では、AChRの密度は1000倍以上も低くなります。
このように、神経筋シナプスの構造は刺激伝達を行う際に重要な役割を果たしており、この複雑な構造を維持することが、私たちが筋力および筋量を維持する上で必須なのです。
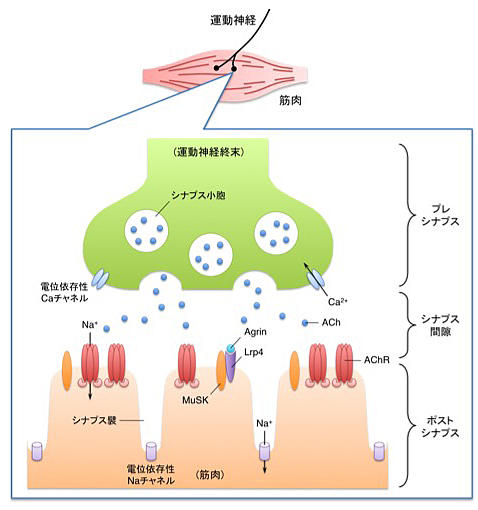
図1 : 神経筋シナプスの構造
重症筋無力症は自己免疫疾患の一つであり、神経筋シナプスに存在する分子の機能が抗体によって阻害されるため、AChによる神経と筋の刺激伝達が抑制されて筋力低下が生じます。本来、抗体とは自分とは異なる異物を認識して排除するために存在していますが、自己免疫疾患では自分の身体の構成成分にまで過剰に反応して攻撃を加える「自己抗体」が生じてしまうのです。現在の時点で、重症筋無力症を引き起こす直接的な原因となる自己抗体は2種類あることが分かっていますが、そのうちの一つがMuSK (筋特異的キナーゼ) という分子に対する自己抗体です。MuSKはAChRとともに筋細胞膜に存在し、AChRを運動神経終末の直下に凝集させる作用を持つ分子です。
本来、重症筋無力症は免疫系の異常によって生じる疾患ですが、原因となる抗原を実験動物に免疫注射し、抗体を産生させることで人工的にヒトと類似の症状を引き起こすことが可能です。私たちはMuSKのタンパクをウサギやマウスに免疫注射し、MuSKに対する抗体が重症筋無力症を発症させ、著しい筋萎縮や筋力低下を引き起こすことを示してきました。さらに、神経筋シナプスの形態を観察すると、筋肉側ではAChRの凝集形が崩れており、電子顕微鏡ではシナプス襞の消失も確認できます (図2)。
興味深いのは、MuSKは神経筋シナプスの筋肉側のみに存在している分子にもかかわらず、抗体によってその機能が抑制されると、運動神経側にも異常が現れるということです。重症筋無力症を発症したマウスの神経筋シナプスでは、運動神経の終末が本来の領域を超えて過剰に伸びるスプラウティングと呼ばれる現象が確認できます (図2)。筋肉のAChRの凝集を維持するためには、運動神経終末から分泌されるagrinという分子が必要です。それと同様に、運動神経の形態を維持するためにも筋肉側から分泌される何らかの因子が必要なのです。この重症筋無力症マウスは筋肉側からのシグナルを受け取ることができないため、運動神経の形態が維持できず変化してしまったことを示しています。
このように、筋肉と運動神経は神経筋シナプスを介した双方向的なシグナルによってお互いの形態や機能を維持しており、MuSKはそのシグナルに重要な役割を果たしています。重症筋無力症では自己抗体によってMuSKの機能が抑制されるため、神経筋シナプスの構造が崩れて筋肉と運動神経に異常が発生し、筋萎縮や筋力低下が引き起こされているのです。
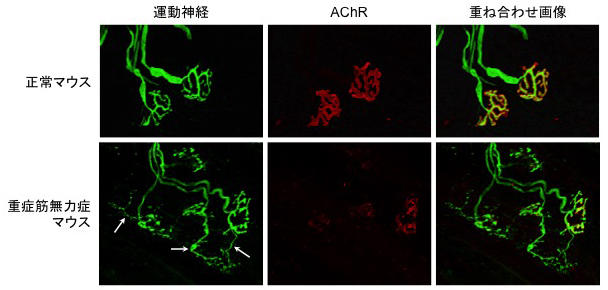
図2 : 重症筋無力症による神経筋シナプスの変化
重症筋無力症を発症すると、AChRの凝集形が崩れ、神経のスプラウティング (矢印部分) が生じる
サルコペニアとは加齢に伴って生じる筋量や筋力の低下を特徴とする症候群です。サルコペニアの進行は身体的に自立していく能力を徐々に奪い、日常生活の質を低下させてしまいます。超高齢社会に突入しつつある現在の日本にとって、サルコペニアへの対策が社会的要請の強い重要な課題になっています。サルコペニアの発症メカニズムは複雑で、様々な要因が関与していると考えられていますが、最終的に現れる症状は筋量および筋力の低下を伴う身体活動量の低下です。高齢者の筋肉では、筋線維が細くなるだけなく、筋線維の数も減少します。また、収縮速度や疲労耐性といった筋線維の性質も変化しており、筋萎縮と筋力低下を引き起こす原因となっています。
筋線維と同様に、神経筋シナプスにおいても加齢によって変化が現れてきます。老齢マウスやラットの神経筋シナプスを観察すると、運動神経終末はスプラウティングを起こし、筋細胞膜のAChRの凝集形が崩れているのが確認できます (図3)。また、加齢による神経筋シナプスの変化は電子顕微鏡による観察でも確認されており、シナプス襞の減少や運動神経終末の縮小などが現れています。最初の項で述べたように、神経筋シナプスの構造は刺激伝達を効率良く行うために特殊化されており、この複雑な構造を維持することが筋量および筋力を維持する上で必須です。そのため、加齢に伴う神経筋シナプスの形態変化がサルコペニアの筋萎縮や筋力低下に関与しているのではないかと思われます。
私たちはこれまで、重症筋無力症の動物モデルを用いて神経筋シナプスの役割を研究してきました。重症筋無力症はサルコペニアとは根本的に発症メカニズムが異なりますが、これら2つに現れる筋萎縮や筋力低下といった症状には、神経筋シナプスの形態変化が共通して現れています。そのため、私たちが作成した重症筋無力症の動物モデルが、サルコペニアの発症メカニズムを解明する上でも役に立つ日が来ると信じています。
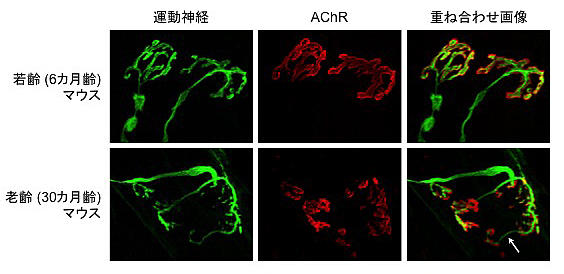
図3 : 加齢による神経筋シナプスの変化
老齢マウスではAChRの凝集形が崩れ、神経のスプラウティング (矢印部分) が生じている
現在、サルコペニアによる筋萎縮の診断には、MRI (磁気共鳴画像) やCT (コンピュータ断層撮影)、DEXA (二重エネルギーX線吸収測定) といった画像診断法が主に用いられています。しかしながら、これらの測定は大型の機器を必要とするため、利用できる医療施設が限られています。さらに、従来の方法はすでに発症したサルコペニアを診断することは可能ですが、サルコペニアのリスクが高い高齢者を未然に見出すことは難しいと言わざるを得ません。サルコペニアを早期に診断して適切な治療を行うためにも、筋肉の状態を正確に把握し、低コストで利用できるバイオマーカー (生体指標) が望まれています。サルコペニアに特異性の高い分子を見つけ出すためにも、その発症メカニズムを明らかにすることが重要なのです。
先ほどの項では、神経筋シナプスの加齢変化とサルコペニアの関係について述べました。興味深いことに、加齢によって筋萎縮や筋力低下の症状が明確に現れてくる前に、神経筋シナプスではすでに形態変化が生じているのです。このような現象は、重篤な筋萎縮と筋力低下をきたすALS (筋萎縮性側索硬化症、アイス・バケツ・チャレンジが行われた病気です) でも確認されています。つまり、神経筋シナプスは筋萎縮へと向かうスタート地点である可能性が高いと言えます。もしかしたら、神経筋シナプスには筋萎縮のバイオマーカー候補となる分子が多く隠されているのかもしれません。今後、サルコペニアの予防・治療法を開発していく上で、神経筋シナプスは重要なターゲットになっていくはずです。