メンバー
| リーダー |
研究副部長 豊田 雅士 |
|---|
| 研究員 |
佐々木 紀彦、板倉 陽子 |
|---|
| 外部研究員 |
重本 和宏 |
|---|
| 研究生 |
大学院生2名、卒研生1名 |
|---|
キーワード
心血管病、老化/細胞老化、糖鎖、血管/毛細血管、血管透過性、動脈硬化、心-腎臓器連関、組織再生、幹細胞
主な研究
1.心臓組織の機能維持と加齢変容に関する研究
2.血管および血管を介した臓器間相互作用による加齢性疾患発症の機序に関する研究
3.心臓組織機能の維持・再生とその機序に関する研究
研究紹介
高齢者人口の増加や昨今の呼吸器感染症の流行に伴い、今後心不全や呼吸不全の患者が急増する、「心不全・呼吸器不全パンデミック」になることが予測されています。循環器疾患に対する治療は日々進歩していますが、将来訪れる懸念を払拭するためには地道な基礎研究が重要です。
私たちは、心血管系に関わる加齢性疾患の発症機序の解明、予防につながる基礎研究に取り組んでいます。
心臓は一生涯動き続け、全身に張り巡らされた血管網を介して全身に酸素や栄養素を供給しており、生命維持に欠かせません。実際に加齢に伴う循環器機能の衰えは、頭痛・動悸・疲労感・胸痛など多岐にわたる自覚症状として現れ、身体活動量の低下につながります。そしてしばしば精神面へと影響し、生活の質(QOL)の著しい低下をもたらすことになります。しかしこうした自覚症状が加齢に伴う"自然に起こる症状"なのか、それとも、"重大な疾患につながる兆候"なのかを区別することは意外に難しく、時として病気の診断が遅れてしまい、重症化してしまうこともあります。私たちは、組織機能が低下し重大な障害をもたらす遥か前に起こっているであろう「組織の中の小さな変化」をいち早く捉えることを目指しています。また低下してしまった機能を再生させるための研究にも挑んでいます。
私たちの研究の成果が、将来いち早い診断・治療に結びつくだけでなく、心血管病の発症を予防することにもつながることを期待して、研究に取り組んでいます。
最近の研究成果
1) Nakamura M, Yoshida-Kikkawa Y, Sugiura K, Itakura Y, Ohse K, Sasaki N, Ito Y, Toyoda M. Assessment of permeability in deep tissue capillaries using a new method reflects the nutrient supply status in a healthy heart. Regen Ther 30:900-909, 2025.
DOI: https://doi.org/10.1016/j.reth.2025.10.005
Erratum: Regen Ther 30:1067-1068, 2025.
DOI: https://doi.org/10.1016/j.reth.2025.11.001
概要:
心臓内部毛細血管から漏出する物質の検出に成功するとともに、それを評価する方法を開発。この評価法を用いて、血管内の物質が毛細血管から心臓内に漏出・拡散する範囲が老齢で縮小することを明らかにしました。これは、心臓組織への栄養素補給が加齢で低下することを示唆しています。
2) Sasaki N, Kawakami K, Itakura Y, Fujita T, Miyagawa S, Ishigami T, Kubo H, Miura Y, Chiba Y. Characterization of extracellular vesicles derived from cortical bone stem cells compared with mesenchymal stem cells. Mol Cell Biochem 480(11):5861-5876, 2025.
DOI: https://doi.org/10.1007/s11010-025-05348-2
概要:
2種類の間葉系細胞由来エクソソームの比較を行いました。その結果、含有タンパク質や表面糖鎖に違いを見出しました。特に、皮質骨由来細胞のエクソソームが骨髄由来細胞のエクソソームよりも、血管内皮細胞への取り込みが高く、炎症惹起の亢進に働くことを明らかにしました。
3) Ding Y, Kowada T, Matsui T, Sasaki N, Mizukami S. A Cell-Surface-Targeted Fluorogenic Probe for Detection of Sulfatase 2 Activity. Bioconjugate Chem 36(9):1980-1986, 2025.
DOI: https://doi.org/10.1021/acs.bioconjchem.5c00251
概要:
細胞外に分泌され、細胞外マトリックスや細胞表面のへパラン硫酸の硫酸化を調節しているスルファターゼの活性を生きた細胞表面で検出するツールを開発しました。スルファターゼを発現している細胞の検出や、活性調節機構の研究、さらにスルファターゼの阻害剤開発などに役立つと期待されます。
1.心臓組織の機能維持と加齢変容に関する研究
心臓は多くの種類の細胞で構成され機能しており、それらを支えるために常時必要な栄養素が補給され、また細胞からの老廃物を速やかに排出されています。
心臓機能は、加齢とともに低下すると言われています。そこで私たちは、まず、細胞の表層を覆う糖鎖(下記「関連情報」を参照)に着目して加齢に伴う心臓内の変化をマウスの心臓で追跡しました。そうすると、心臓組織内では時空間的な分子の変化が生じていることがわかりました (Regen Ther, 2023)。マウス心臓の外側付近(左心室壁)と内側付近(乳頭筋:弁を支える筋肉組織)では時間の経過(加齢)とともにシアル酸と呼ばれるタンパク質を修飾する糖鎖の末端に位置する構造が減少していることが認められました(図1:末端シアル酸を認識するレクチンの1つMAL-Iの染色像を示す)。このシアル酸の減少は、ヒトの心臓組織由来の培養細胞の老化でも同様な結果が示されています (Biogerontology, 2021)。
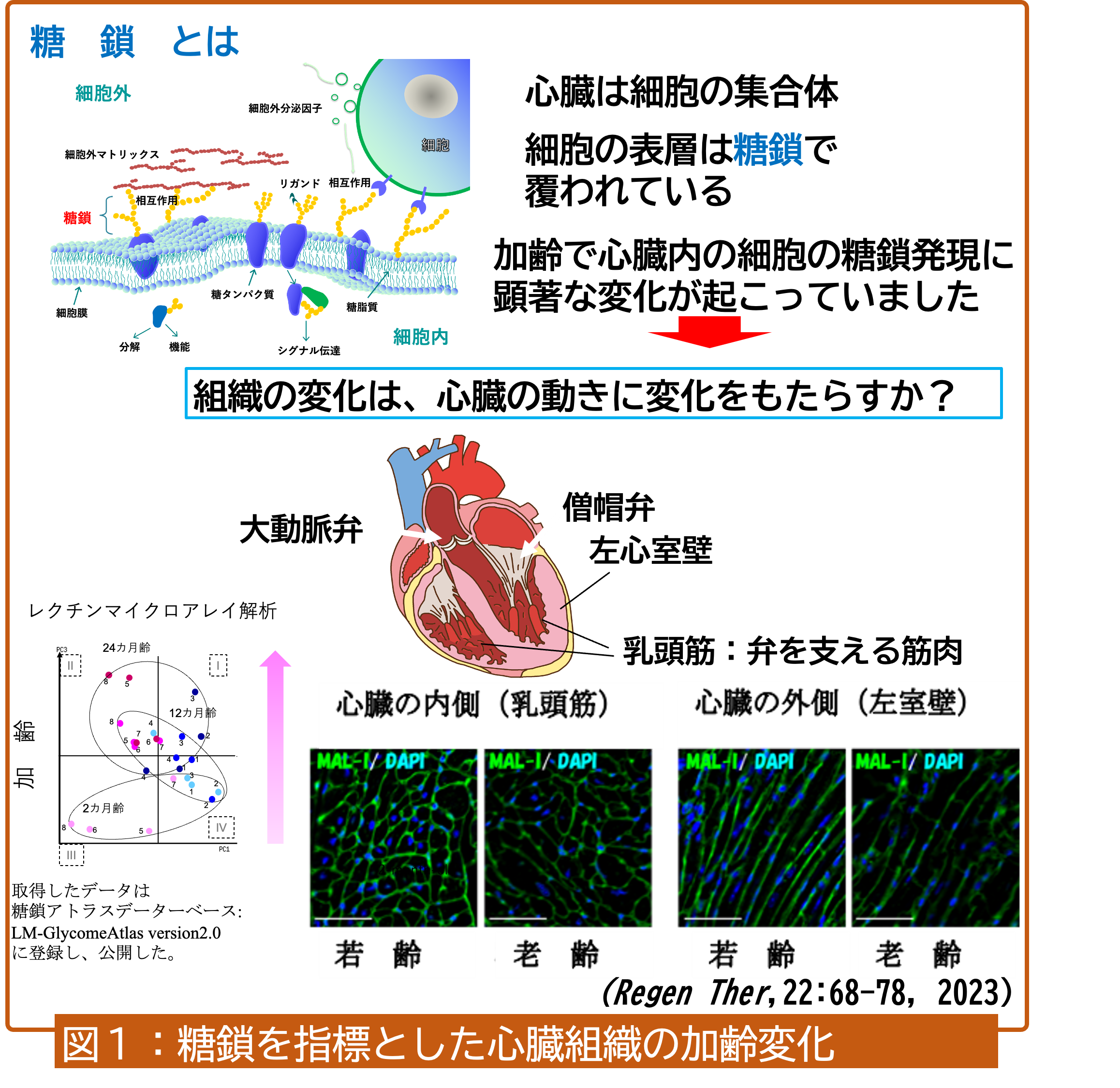
私たちは、この解析でもう1つ注目したのは、血管のマーカーとして知られているレクチンGSL-IB4の量的変化が顕著に認められたことです (Regen Ther, 2023)。多くの細胞が一丸となって機能している心臓は、組織内に血管網が張り巡らされており、血管機能が心臓機能を支えていることがわかります。加齢による血管機能の変化は、心臓を構成する各細胞の役割に大きく関わってくると考えられます。そこで私たちは、心臓機能に果たす血管、特に毛細血管の役割に着目して検討を行っています。
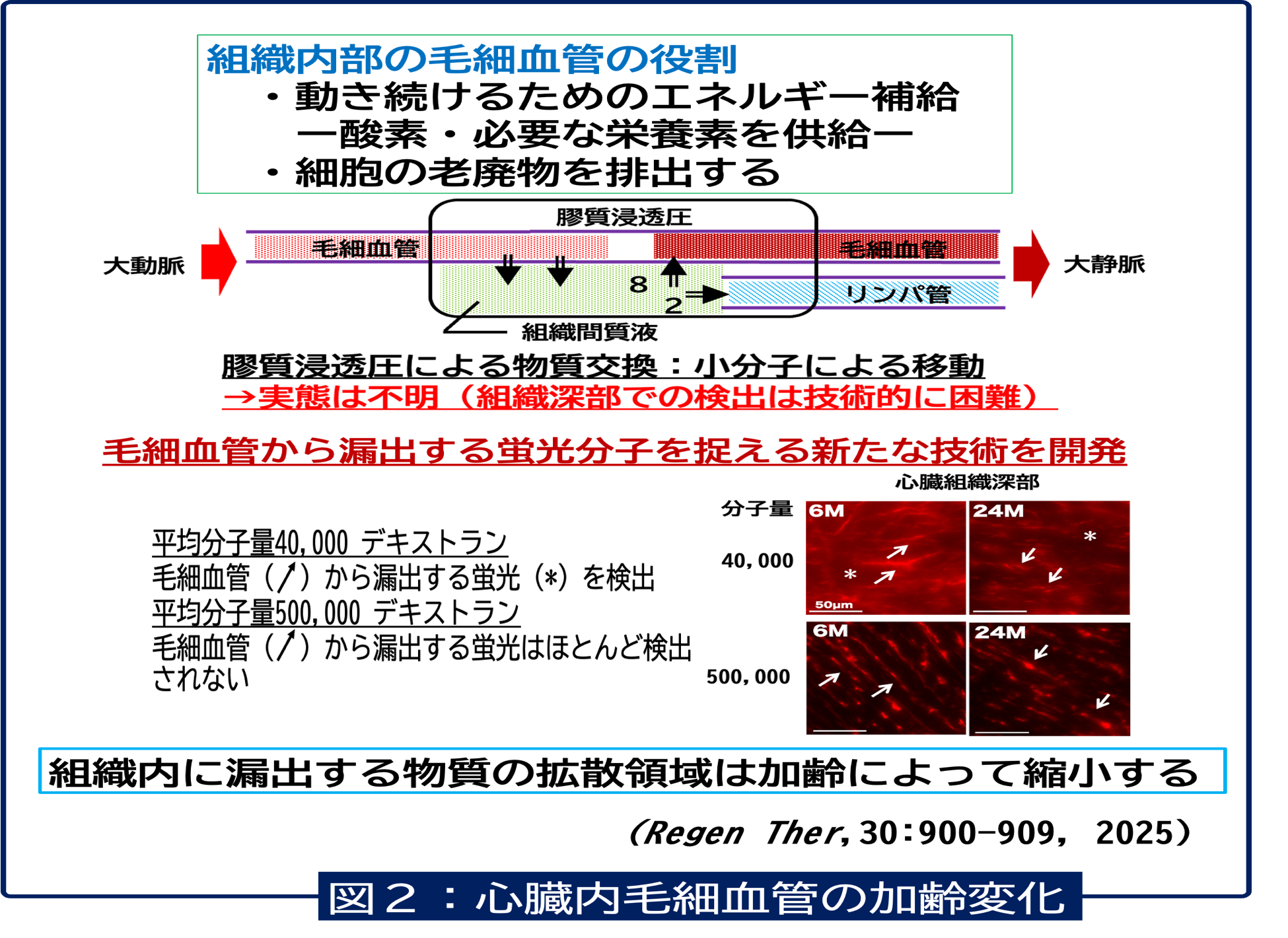
毛細血管は、組織内部で物質の交換機能を担っています。しかし組織内部の深い場所に存在する小さく細い血管で行われる物質のやり取りがどのように行われているかはよくわかっていません。これは最新のイメージング技術を使っても検出することが難しいためです。私たちは、この課題を解決するための検討を行い、マウスに蛍光分子を投与し心臓内毛細血管から漏出する検出技術を開発しました(図2)。この技術を活用して、若齢と老齢マウスで、心臓組織内への蛍光分子の拡散領域に違いがあることがわかりました (Regen Ther, 2025)。これは、老齢によって栄養素の組織内への拡散が縮小していることを示しています。これが心臓機能とどのように関わるかについて現在検討を進めています。
2.血管および血管を介した臓器間相互作用による加齢性疾患発症の機序に関する研究
高齢期における心血管疾患発症において最も大きなリスクとなるのが、動脈硬化です。私たちは、動脈硬化がどのようなプロセスで形成され、疾患に結びつくのかを検討を進めています。
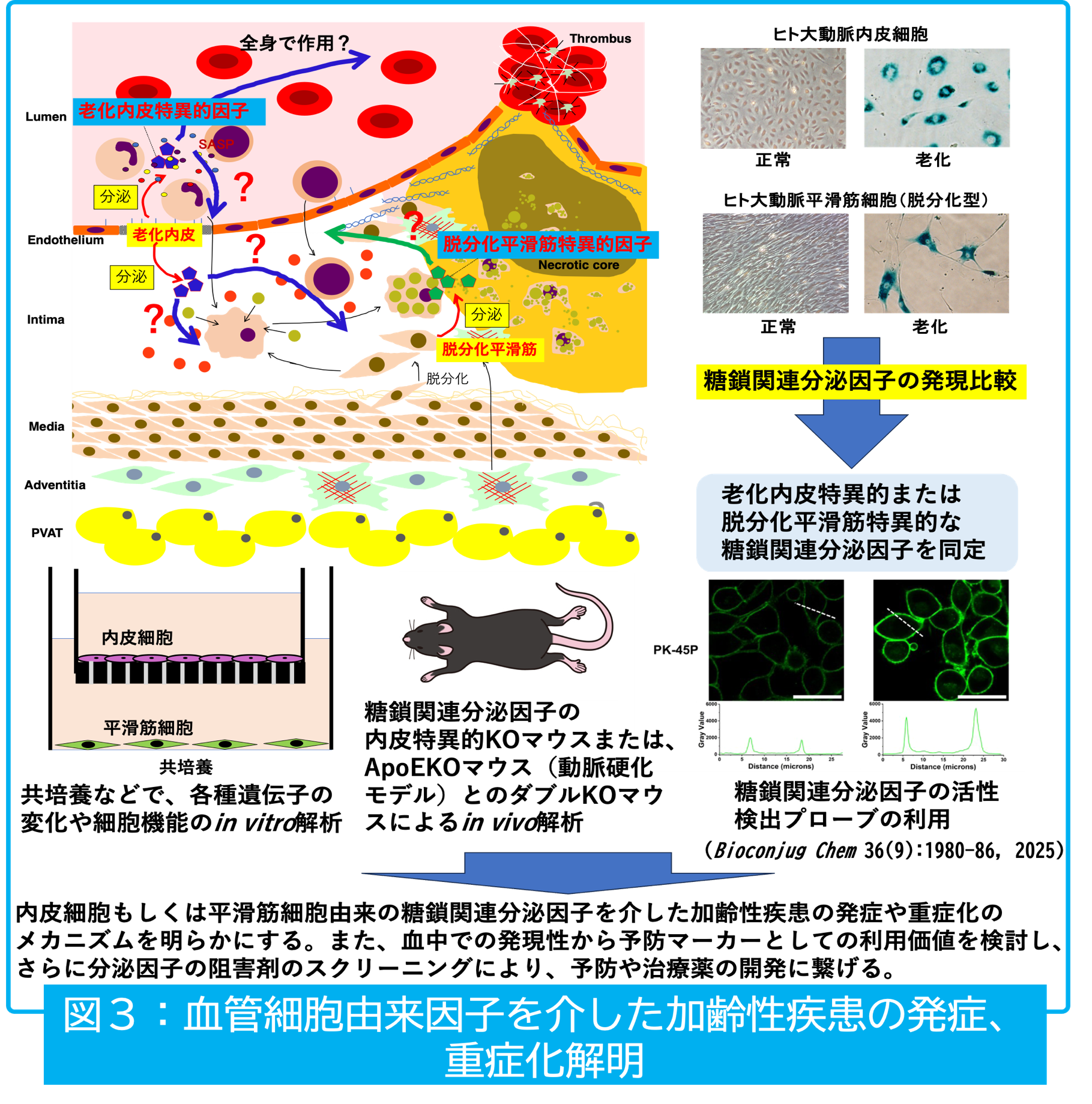
動脈硬化の主役となる2つの細胞、血管内皮細胞と血管平滑筋について、まず老化に伴ってどのような分子的挙動の変化を起こすかを検討してきました。血管内皮細胞表面では、ガングリオシドと呼ばれる糖脂質の1種であるGM1が老化や炎症によって増加し、NO産生に関わるインスリンシグナルの低下に関わることを明らかにしました(JBC, 2015; Oncotarget, 2017)。一方、血管平滑筋細胞については、動脈硬化の進展に関わる脱分化型平滑筋細胞の増殖と遊走にガングリオシドの一群が関わっていることを明らかにしました(Front Cell Dev Biol, 2022)。細胞表面の糖鎖が、老化に伴う機能低下や病態の進行に関わることが示唆されています。
さらに私たちは、細胞間相互作用を介した疾患形成に着目し、細胞外に分泌される糖鎖関連因子の発現変化を調べ、各細胞において、老化に伴って特異的に増加する因子を見出しました。現在は、そのうちの一つの因子について、共培養によるin vitroの動脈硬化モデルによる検討や、内皮細胞特異的にノックアウトした動脈硬化モデルマウスでのin vivoでの検討を行っています(図3)。今後は、動脈硬化との関連を明らかにし、動脈硬化を伴う加齢性疾患の予防や治療法の開発に繋げたいと考えています。
高齢期の疾患は、複合的に起こることが知られています。そこで私たちは、血管を介して臓器と臓器の相互作用に着目し"臓器連関"における加齢との関連性を調べています。人が生きる中で心臓と周辺臓器との関連性は切っても切り離せません。特に心臓と直接血管で連結されている肺への影響や心臓機能の低下を知らせるマーカーを分泌する腎臓における変化は、血管との関りが大きいと予想されます。加齢と病態との関連性を明らかにするために、「細胞社会」だけではなくこのようにもう少し大きな「臓器社会」における糖鎖の役割を明らかにすることを目指しています。
そこで私たちは、血管における細胞の糖鎖解析に加え、心臓と同様に、様々な臓器の糖鎖パターンの解析を行い、臓器特異的な変化や疾患との関わりを探っています。まず、加齢における臓器ごとの糖鎖のパターンの変化を把握するため、マウスの各組織からの抽出物における糖鎖プロファイリングを行っています。ここで得られた情報は、順次公共データベース(LM-GlycomeAtlas ver.2.1; https://glycosmos.org/lm_glycomeatlas/index)に登録し、公開しています(これまでに、心臓の加齢変化は登録・公開済み)。これらの結果を基に、各臓器においてどのような細胞が、加齢プロセスにおける関連した変化を生じているのかを把握し、その機能的役割の解明を目指しています。特に心臓機能と連関する腎臓や肺の解析に着目して解析を進めています(図4)。
こうした解析を通して、加齢と心血管病態との関連性を明らかにし、「細胞社会」から「臓器社会」における糖鎖の役割を明らかにしていきたいと考えています。

3.心臓組織機能の維持・再生とその機序に関する研究
低下した心臓機能を再生させる研究が近年著しい進展を見せています。人工臓器を活用した治療、増殖能と分化能を有する幹細胞(多能性幹細胞-ES細胞、iPS細胞-や、様々な組織に存在する組織幹細胞-造血幹細胞、間葉系幹細胞、神経幹細胞など-)による細胞移植医療(いわゆる再生医療)は、基礎研究からすでに臨床研究の段階まできています。しかし複合的な疾患を抱えていることが少なくない高齢者にとって、こうした治療を受けるには多角的視点から考慮する必要性があるなど、ハードルが高いのが現状です。
私たちは、高齢者の生活の質を落とすことなく心臓機能を維持・再生させるための基礎研究を行なっています。また、機能低下する前段階で発症を予防するために何が必要かを探った研究を進めています。
関連情報
研究所ホームページ「研究トピックス」(日本語)
日本語総説
- 板倉陽子. 「糖鎖関連因子による高齢者心疾患の解明と予防へ向けた取り組み」 Precision Medicine(北隆館), 2025.9.
- 佐々木紀彦. 「細胞老化と糖鎖」, 基礎老化研究誌(日本基礎老化学会), 46(1):23-31, 2022.
- 豊田雅士. 「血管の老化と慢性炎症」, 別冊BIO Clinica (北隆館), 10(2): 25-30, 2021.
- 佐々木紀彦. 「(カラーグラビア)老化と糖鎖研究」, 別冊BIO Clinica (北隆館), 10(2): 1-5, 2021.
- 佐々木紀彦、板倉陽子、豊田雅士.「老化関連疾患の予防、治療法の開発に向けた『老化と糖鎖』」,生化学会誌,90(5):719-723, 2018.
主要文献(原著論文)
- Nakamura M, Yoshida-Kikkawa Y, Sugiura K, Itakura Y, Ohse K, Sasaki N, Ito Y, Toyoda M. Assessment of permeability in deep tissue capillaries using a new method reflects the nutrient supply status in a healthy heart. Regen Ther 30:900-909, 2025.
DOI: https://doi.org/10.1016/j.reth.2025.10.005
Erratum: Regen Ther 30:1067-1068, 2025.
DOI: https://doi.org/10.1016/j.reth.2025.11.001
- Rai D, Seko Y, Ishii T, Kaneda M, Toyoda M, Umezawa A. Linking order of RAX and OTX2 following CRX in polycistronic vectors can partially determine efficacy of direct conversion to photoreceptor-like cells in vitro. Cell Biochem Biophys in press, 2025.
DOI: https://doi.org/10.1007/s12013-025-01921-0
- Ando J, Murai K, Michiyuki T, Takahashi I, Iida T, Kogo Y, Toyoda M, Saito Y, Murayama S, Kurihara M, Watanabe R. Digital SERS bioanalysis of single enzyme biomarkers. Proc Natl Acad Sci USA 122(35): e2510559122, 2025.
DOI: https://doi.org/10.1073/pnas.2510559122
研究所ホームページ「プレスリリース」(日本語)https://www.tmghig.jp/research/release/2025/0902.html
研究所ホームページ「研究成果」(日本語)https://www.tmghig.jp/research/info/archives/016740/index.html
- Sasaki N, Kawakami K, Itakura Y, Fujita T, Miyagawa S, Ishigami T, Kubo H, Miura Y, Chiba Y. Characterization of extracellular vesicles derived from cortical bone stem cells compared with mesenchymal stem cells. Mol Cell Biochem 480(11):5861-5876, 2025.
DOI: https://doi.org/10.1007/s11010-025-05348-2
- Ding Y, Kowada T, Matsui T, Sasaki N, Mizukami S. A Cell-Surface-Targeted Fluorogenic Probe for Detection of Sulfatase 2 Activity. Bioconjugate Chem 36(9):1980-1986, 2025.
DOI: https://doi.org/10.1021/acs.bioconjchem.5c00251
- Umezawa A, Fukuda A, Horikawa R, Uchida H, Enosawa S, Oishi Y, Nakamura N, Sasaki K, YanagiY, Shimizu S, Nakao T, Kodama T, Sakamoto S, Hayakawa I, Akiyama S, Saku N, Miyata S, Ite K, Javaregowda PK, Toyoda M, Nonaka H, Nakamura K, Ito Y, Fukuhara Y, Miyazaki O, Nonaka S, Nakabayashi K, Haga C, Yoshioka T, Masuda A, Ohkura T, Yamazaki‑Inoue M, Machida M, Abutani‑Sakamoto R, Miyajima S, Akutsu H, Matsubara Y, Igarashi T and KasaharaM. First‑in‑human clinical study of an embryonic stem cell product for urea cycle disorders. Stem Cell Res Ther 16:120, 2025.
DOI: https://doi.org/10.1186/s13287-025-04162-3
- Iida T, Ando J, Yoshimura M, Makino A, Nakano M, Kogo Y, Shinoda H, Toyoda M, Noda T, Watanabe R. Portable wide-field femtoliter-chamber imaging system for point-of-care digital bioanalysis. iScience 27(9):110868, 2024.
DOI: https://doi.org/10.1016/j.isci.2024.110868
研究所ホームページ「プレスリリース」(日本語)https://www.tmghig.jp/research/release/2024/0911.html
- Ito M, Katoh M, Sassa T, Ko T, Fujita K, Yamada S, Miura K, Toyoda M, Takada S, Tobita T, Katagiri M, Kubota M, Yamada T, Hatsuse S, Morita H, Ikeuchi M, Matsuura K, Umezawa A, Nomura S, Aburatani H, and Komuro I. LMNA p.Q353R mutation causes dilated cardiomyopathy through impaired vitamin D signaling. Circulation 150(12):971-974, 2024.
DOI: https://doi.org/10.1161/CIRCULATIONAHA.124.069972
- Yamada S, Ko T, Ito M, Sassa T, Nomura S, Okuma H, Sato M, Imasaki T, Kikkawa S, Zhang B, Yamada T, Seki Y, Fujita K, Katoh M, Kubota M, Hatsuse S, Katagiri M, Hayashi H, Hamano M, Takeda N, Morita H, Takada S, Toyoda M, Uchiyama M, Ikeuchi M, Toyooka K, Umezawa A, Yamanishi Y, Nitta R, Aburatani H, Komuro I. TEAD1 trapping by the Q353R-Lamin A/C causes dilated cardiomyopathy. Sci Adv 9(15):eade7047, 2023.
DOI: https://doi.org/10.1126/sciadv.ade7047
- Itakura Y, Hasegawa Y, Kikkawa Y, Murakami Y, Sugiura K, Nagai-Okatani C, Sasaki N, Umemura M, Takahashi Y, Kimura T, Kuno A, Ishiwata T, Toyoda M. Spatiotemporal changes of tissue glycans depending on localization in cardiac aging. Regen Ther 22:68-78, 2023.
DOI: https://doi.org/10.1016/j.reth.2022.12.009
研究所ホームページ「研究成果」(日本語)https://www.tmghig.jp/research/release/2023/0111.html
- Sasaki N, Hirano K, Shichi Y, Itakura Y, Ishiwata T, Toyoda M. PRC2-dependent regulation of ganglioside expression during dedifferentiation contributes to the proliferation and migration of vascular smooth muscle cells. Front Cell Dev Biol 10:1003349, 2022.
DOI: https://doi.org/10.3389/fcell.2022.1003349
研究所ホームページ「研究成果」(日本語)https://www.tmghig.jp/research/release/2022/1018.html
- Nagai-Okatani C, Zou X, Matsuda A, Itakura Y, Toyoda M, Zhang Y, Kuno A. Tissue glycome mapping: lectin microarray-based differential glycomic analysis of formalin-fixed paraffin-embedded tissue sections. Methods Mol Biol 2460:161-180, 2022.
DOI: https://doi.org/10.1007/978-1-0716-2148-6_10
- Itakura Y, Sasaki N, Toyoda M. Glycan characteristics of human heart constituent cells maintaining organ function: relatively stable glycan profiles in cellular senescence. Biogerontology 22(6):623-637, 2021.
DOI: https://doi.org/10.1007/s10522-021-09940-z
研究所ホームページ「研究成果」(日本語)https://www.tmghig.jp/research/release/2021/1111.html
- Sasaki N, Itakura Y, Mohsin S, Ishigami T, Kubo H, Chiba Y. Cell Surface and Functional Features of Cortical Bone Stem Cells. Int J Mol Sci 22:11849, 2021.
DOI: https://doi.org/10.3390/ijms222111849
- Sasaki N, Toyoda M, Ishiwata T. Gangliosides as signaling regulators in cancer. Int J Mol Sci 22(10):5076, 2021. (Review)
DOI: https://doi.org/10.3390/ijms22105076
- Kosugi M, Otani M, Kikkawa Y, Itakura Y, Sakai K, Ito T, Toyoda M, Sekita Y, Kimura T. Mutations of histone demethylase genes encoded by X and Y chromosomes, Kdm5c and Kdm5d, leads to noncompaction cardiomyopathy in mice. Biochem Biophys Res Commun 525(1):100-106, 2020.
DOI: https://doi.org/10.1016/j.bbrc.2020.02.043
- Sasaki N, Itakura Y, Toyoda M. Rapamycin promotes endothelial-mesenchymal transition during stress-induced premature senescence through the activation of autophagy. Cell Commun Signal 18(1):43, 2020.
DOI: https://doi.org/10.1186/s12964-020-00533-w
研究所ホームページ「研究成果」(日本語)https://www.tmghig.jp/research/release/2020/0313.html
- Sasaki N, Toyoda M. Vascular diseases and gangliosides. Int J Mol Sci 20(24), E6362, 2019. (Review)
DOI: https://doi.org/10.3390/ijms20246362
- Sasaki N, Itakura Y, Toyoda M. Gangliosides contribute to vascular insulin resistance. Int J Mol Sci 20(8):1819, 2019. (Review)
DOI: https://doi.org/10.3390/ijms20081819
- Itakura Y, Sasaki N, Toyoda M. Qualitative and quantitative alterations in intracellular and membrane glycoproteins maintain the balance between cellular senescence and human aging. Aging (Albany NY), 10(8):2190-2208, 2018.
DOI: https://doi.org/10.18632/aging.101540
- Miura Y, Hashii N, Ohta Y, Itakura Y, Tsumoto H, Suzuki J, Takakura D, Abe Y, Arai Y, Toyoda M, Kawasaki N, Hirose N, Endo T. Characteristic glycopeptides associated with extreme human longevity identified through plasma glycoproteomics. Biochim Biophys Acta, 1862(6):1462-1471, 2018.
DOI: https://doi.org/10.1016/j.bbagen.2018.03.025
- Sasaki N, Itakura Y, Toyoda M. Ganglioside GM1 contributes to extracellular/intracellular regulation of insulin resistance, impairment of insulin signaling and down-stream eNOS activation, in human aortic endothelial cells after short- or long-term exposure to TNFα. Oncotarget, 9(5):5562-5577, 2018.
DOI: https://doi.org/10.18632/oncotarget.23726
- Sasaki N, Itakura Y, Toyoda M. Sialylation regulates myofibroblast differentiation of human skin fibroblasts. Stem Cell Res Ther, 8(1):81, 2017.
DOI: https://doi.org/10.1186/s13287-017-0534-1
- Zou X, Yoshida M, Nagai-Okatani C, Iwaki J, Matsuda A, Tan B, Hagiwara K, Sato T, Itakura Y, Noro E, Kaji H, Toyoda M, Zhang Y, Narimatsu H, Kuno A. A standardized method for lectin microarray-based tissue glycome mapping. Sci Rep, 7:43560, 2017.
DOI: https://doi.org/10.1038/srep43560
- Itakura Y, Sasaki N, Kami D, Gojo S, Umezawa A, Toyoda M. N- and O-glycan cell surface protein modifications associated with cellular senescence and human aging. Cell Biosci, 6:14, 2016.
DOI: https://doi.org/10.1186/s13578-016-0079-5
- Sasaki N, Itakura Y, Toyoda M. Ganglioside GM1 contributes to the state of insulin resistance in senescent human arterial endothelial cells. J Biol Chem, 290:25475-25486, 2015.
DOI: https://doi.org/10.1074/jbc.M115.684274



